Oxigén-difluorid
| Oxigén-difluorid | |||
|
|||
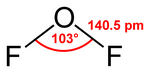
| Az oxigén-difluorid szerkezete | |||
| Azonosítás | |||
|---|---|---|---|
| IUPAC név | oxigén-difluorid | ||
| Szinonimák |
oxigén-fluorid |
||
| N o CAS | |||
| N o ECHA | 100,029,087 | ||
| N o EC | 231-996-7 | ||
| N o RTECS | RS2100000 | ||
| PubChem | 24547 | ||
| ChEBI | 30494 | ||
| Mosolyok |
O (F) F , |
||
| InChI |
Std. InChI: InChI = 1S / F2O / c1-3-2 Std. InChIKey: UJMWVICAENGCRF-UHFFFAOYSA-N |
||
| Megjelenés | jellegzetes szagú, színtelen sűrített gáz, folyékony állapotban sárgás-barna | ||
| Kémiai tulajdonságok | |||
| Brute formula |
F 2 O |
||
| Moláris tömeg | 53,9962 ± 0,0003 g / mol F 70,37%, O 29,63%, |
||
| Fizikai tulajdonságok | |||
| T ° fúzió | -223,8 ° C | ||
| T ° forráspontú | -144,75 ° C | ||
| Oldékonyság | 68 cm 3 · L -1 vízben 0 ° C-on , lassú reakció | ||
| Térfogat | 2,421 g · cm -3 hogy 0 ° C-on és 101,3 kPa | ||
| Kritikus pont | -58 ° C ; 4,95 MPa ; 0,5532 g · cm -3 | ||
| Óvintézkedések | |||
| SGH | |||
   Veszély H270, H314, H330, H270 : Tűzet okozhat vagy fokozhat ; oxidálószer H314 : Súlyos égési sérülést és szemkárosodást okoz H330 : Belélegezve halálos |
|||
| WHMIS | |||
    A, C, D1A, E, A : Sűrített gáz kritikus hőmérséklete = −58 ° C C : Az oxidáló anyag oxigén felszabadításával más anyag égését okozza vagy elősegíti. D1A : Nagyon mérgező anyag, közvetlen súlyos hatással . Veszélyes áruk szállítása: 2.3 E osztály : Maró anyag Veszélyes áruk szállítása : 8. osztály Közzététel 1,0% -nál az összetevők közzétételi listája szerint |
|||
| Szállítás | |||
265 : mérgező és oxidáló gáz (elősegíti a tüzet) UN-szám : 2190 : OXIGÉN-DIFLUORID, Sűrített osztály: 2.3 Címkék: 2.3 : Mérgező gázok (megfelel egy nagybetűvel T jelölt csoportoknak, azaz T, TF, TC, TO , TFC és TOC). 5.1 : Oxidáló anyagok 8 : Maró anyagok Csomagolás: -    |
|||
| Egység SI és STP hiányában. | |||
Az oxigén-difluorid , vagy egyszerűbben fluorid oxigén , a kémiai vegyület a képletű OF 2. Ez egy színtelen, nagyon oxidáló gáz .
Készítmény
2 oxigén-difluoridElőször 1929-ben írta le Paul Lebeau francia vegyész Augustin Damien-nel folytatott fluoridkutatása során . Ezt elő elektrolízis az olvadt kálium-fluorid KF és hidrogén-fluorid HF víznyomokat molekulák.
A modern előállítási módszer magában foglalja az F 2 fluor reakciójátnátrium-hidroxid NaOH híg vizes oldatával :
2 F 2+ 2 NaOH→ OF 2+ 2 NaF+ H 2 OReakciók
Oxigén-difluorid fölött bomlik 200 ° C-on , hogy difluor F 2és oxigén O 2 radikális mechanizmus által. Számos fémmel reagálva fluoridokat és oxidokat , valamint nemfémeket kap: OF 2reagál például a foszfor , így foszfor-pentafluorid PF 5és POF 3 foszfor-oxitrifluorid, És a kén , így a kén-dioxid SO 2és kén-tetrafluorid SF 4. A xenon , OF 2adhat xenon tetrafluorid XeF 4valamint xenon-oxifluoridok ( xenon- oxidifluorid XeOF 2és xenon-oxitetrafluorid, XeOF 4 különösen).
Az oxigén-difluorid lassan reagál vízzel, és így hidrogén-fluoridot ad :
A 2 (aq)+ H 2 O (aq)→ 2 HF (aq)+ O 2 (g)Megjegyzések és hivatkozások
- OXIGÉN-DIFLUORID , a Kémiai Biztonság Nemzetközi Programjának biztonsági adatlapja (i) , konzultáltak 2009. május 9-én
- számított molekulatömege a „ atomsúlya a Elements 2007 ” on www.chem.qmul.ac.uk .
- "Oxigén difluorid" bejegyzés az IFA (a munkavédelemért felelős német testület) GESTIS kémiai adatbázisába ( német , angol ), 2018. május 26. (JavaScript szükséges)
- „ Oxygen difluoride ” az adatbázis a vegyi anyagok Reptox a CSST (Quebec szervezet felelős a munkahelyi biztonság és egészségvédelem), elérhető április 25, 2009