Hidrogén klorid
| Hidrogén klorid | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Azonosítás | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| IUPAC név |
sósav hidrogén- klorid- |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o CAS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o ECHA | 100,028,723 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o EC | 231-595-7 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Megjelenés | gáz, színtelen, fanyar szagú. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kémiai tulajdonságok | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Brute formula |
H Cl [izomerek] |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Moláris tömeg | 36,461 ± 0,002 g / mol H 2,76%, Cl 97,23%, |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| pKa | -4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dipoláris pillanat | 1,1086 ± 0,0003 D | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fizikai tulajdonságok | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T ° fúzió | -114 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T ° forráspontú | a 101,3 kPa : -85 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oldékonyság | vízben 20 ° C-on : 720 g · l -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Térfogat |
1.00045 g · l -1 (gáz)
egyenlet:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Telített gőznyomás |
egyenlet:

|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kritikus pont | 51,35 ° C , 8,26 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Hármas pont | 160 K ( -114 ° C ), 13,8 kPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Hangsebesség | 296 m · s -1 ( 0 ° C , 1 atm ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Termokémia | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| S 0 gáz, 1 bar | 186,90 J · K -1 · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Δ f H 0 gáz | -92,31 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Δ vap H ° |
16,15 kJ · mol -1 ( 1 atm , -85 ° C ); 9,08 kJ · mol -1 ( 1 atm , 25 ° C ) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| C o | 29,14 J / mol K ( 25 ° C )
egyenlet:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Óvintézkedések | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SGH | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
   Veszély H314, H331, H314 : Súlyos égési sérülést és szemkárosodást okoz H331 : Belélegezve mérgező |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| WHMIS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
   A, D1A, E, A : Sűrített gáz Abszolút gőznyomás 50 ° C-on = 7.950 kPa D1A : Nagyon mérgező anyag, súlyos azonnali hatással . Veszélyes áruk szállítása: 2.3 E osztály : Maró anyag Veszélyes áruk szállítása: 8. osztály Kiszerelés 1,0% -on, az összetevők leírása szerint lista |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NFPA 704 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2 3 1 W | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Szállítás | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
268 : mérgező és maró gáz UN-szám : 1050 : ANHIDROS HIDROGÉN-KLORID Osztály: 2.3 Osztályozási kód: 2TC : Cseppfolyósított gáz, mérgező, maró; Címkék: 2.3 : Mérgező gázok (megfelel a nagybetűvel T jelölt csoportoknak, azaz T, TF, TC, TO, TFC és TOC). 8 : Maró anyagok  
2186 : HIDROGÉN-KLORID, HŰTETT FOLYADÉK Osztály: 2.3 Osztályozási kód: 3TC : Hűtött cseppfolyósított gáz, mérgező, maró; Címkék: 2.3 : Mérgező gázok (megfelel a nagybetűvel T jelölt csoportoknak, azaz T, TF, TC, TO, TFC és TOC). 8 : Maró anyagok   A 2.2.2.2.2. Fejezet szerint a hűtött, cseppfolyósított hidrogén-kloridot nem engedélyezik az ADR " ADR 2021 Vol 1 " [PDF] , ENSZ szállítása,2020( ISBN 978-92-1-139177-0 , konzultáció dátuma: 21/04/30 ) , p. 136 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Belélegzés | friss levegőre juttatni, esetleg kardiopulmonáris újraélesztést | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bőr | távolítsa el a szennyezett ruhákat, bő vízzel mossa le, mutassa meg orvosának | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Szemek | mossa le bő vízzel, miközben a szemhéjakat nyitva tartja, mutasson szemészt | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Lenyelés | ne igyon, ne váltson hányást, forduljon orvoshoz. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ökotoxikológia | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Szagküszöb | alacsony: 0,25 ppm magas: 10,06 ppm |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Egység SI és STP hiányában. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
A hidrogén-kloridot , kémiai szimbólum H Cl , egy testület, amely a klórt és a hidrogén , színtelen, mérgező és rendkívül korrozív . Under környezeti hőmérsékleten és nyomáson , ez egy gáz képező fehér füst érintkezve páratartalom . Ezek a füstök sósavból , hidrogén-klorid ionos vizes oldatából állnak.
A sósavhoz hasonlóan a hidrogén-klorid fontos vegyi anyag a kémia , az ipar vagy a tudomány területén. A HCl elnevezés néha helytelenül a sósavra utal a tiszta hidrogén-klorid helyett. A kémikusok néha gázos vagy vízmentes sósavról beszélnek hidrogén-kloridra utalva.
Történelem
A hidrogén-klorid a középkor óta ismert , amikor az alkimisták tudták, hogy a sósav (akkor még só vagy acidum salis néven ismert ) bizonyos körülmények között a tengeri savgáznak nevezett gőzökhöz kötődik .
A XVII th században , Johann Rudolf Glauber használt só ( nátrium-klorid ) és a kénsav előállítására a nátrium-szulfát , a szekunder reakciótermék hidrogén-klorid:
2 NaCl + H 2 SO 4 → 2 HCI + Na 2 SO 4.Ezt a felfedezést néha Carl Wilhelm Scheele- nek tulajdonítják , aki szintén 1772-ben hajtotta végre ezt a reakciót. Joseph Priestley 1772-ben kapott tiszta hidrogén-kloridot, 1818-ban pedig Humphry Davy bizonyította, hogy ez a gáz hidrogénből és klórból áll .
Az ipari forradalom során a lúgos anyagok , és különösen a nátrium-karbonát iránti igény egyre fontosabbá vált. Nicolas Leblanc új ipari eljárást dolgozott ki a nátrium-karbonát előállítására . A Leblanc-eljárás során a sót ( nátrium-klorid ) kénsav , kréta és szén felhasználásával nátrium-karbonáttá alakítják , másodlagos hidrogén-klorid-termeléssel. Az alkáli törvény 1863-ban az Egyesült Királyságban történő elfogadásáig ez utóbbi a levegőbe került. A termelők a nátrium-karbonátot, majd kellett oldjuk fel vízben , amely lehetővé tette, hogy készítsen sósavval ipari méretekben. Később, a Hargreaves folyamat alakult, hasonlóan a Leblanc folyamat azzal az eltéréssel, hogy a kénsav helyébe a kén-dioxid , a víz és a levegő . A XX . Század elején a Leblanc-eljárást felváltotta a Solvay-folyamat , amely nem termel hidrogén-kloridot. A hidrogén-klorid azonban még mindig lépés a sósav előállításában .
Kémia
A molekula sósav hidrogén-klorid egy kétatomos molekula, amely egy atom a hidrogén- H és egy atom klór Cl, kapcsolódik egy egyszeres kötés . Mivel a klór sokkal negatívabb, mint a hidrogén, a kötés polarizált. Ennek eredményeként a molekula nagy dipólusmomentumot hordoz , negatív δ részleges töltéssel - amelyet a klóratom hordoz, és pozitív részleges töltéssel δ +, amelyet a hidrogénatom hordoz. A hidrogén-klorid tehát poláris molekula . Nagyon oldódik a vízben , és a poláros oldószerekben .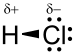
Vízzel érintkezve, hidrogén-klorid ionizálja alkotnak Cl - kloridot anionok és oxónium H 3 O + kationok (H + szolvatált ):
HCI + H 2 O → H 3 O + + Cl -A reakció eredményeként kapott oldatot sósavnak nevezzük . Ez egy erős sav , amely azt jelenti, hogy a savasságot konstans K egy (amely kapcsolatban van a disszociációs rátája a HCI-molekula) igen magas: hidrogén-klorid disszociál szinte teljesen vízben.
A hidrogén-klorid víz hiányában is savként viselkedik . Például a HCl feloldódhat más oldószerekben, például metanolban és protonátionokban vagy molekulákban, katalizátorsavként működve bizonyos kémiai reakciókhoz, amelyekhez vízmentes körülmények (víz teljes hiánya) szükségesek:
HCl + CH 3 OH → CH 3 O + H 2 + Cl -(protonálódás sósavval, a metanol-molekula CH 3 OH)Savas jellege miatt a hidrogén-klorid maró gáz , különösen nedvesség jelenlétében ( 2 - 5 ppm víz elegendő).
Termelés
A legtöbb képződő hidrogén-kloridot az iparban használnak előállítására sósav .
Az iparban a hidrogén-klorid előállításának általános módszere a "HCl-kemence", amelyben a dihidrogén és a gáznemű klór exoterm reakcióban hidrogén-kloridot képez:
Cl 2 + H 2 → 2 HCIEzt a reakciót egy nagyon tiszta termék előállítására használják, amelyet elsősorban az élelmiszeripar számára szánnak.
A hidrogén-klorid klórból és hidrogéntartalmú vegyületekből , például szénhidrogénekből is előállítható . A szerves vegyületek klórozása hidrogén-klorid előállításához vezethet:
RH + Cl 2 → R-Cl + HCIHa klórozott termékeket hidrogén-fluoriddal reagáltatunk fluorozott vegyületek előállítására, hidrogén-klorid keletkezik:
R-Cl + HF → RF + HClAmikor ezek a reakciók vízmentes közegben (víz nélkül) játszódnak le, gázos HCl keletkezik.
Hidrogénklorid ipari méretekben is előállítható nátrium-kloridból (NaCl) és kénsavból :
2 NaCl + H 2 SO 4 → 2 HCI + Na 2 SO 4 .
Hidrogén-klorid szintézise
A hidrogén-kloridot úgy állíthatjuk elő, lassú hozzáadásával a víz (vagy sav ), hogy egyes klórozott reagensek feleslegének, mint például a foszfor-klorid , a tionil-klorid (SOCI 2 ) vagy az acil-kloridok . Túl sok víz hozzáadása a képződött hidrogén-klorid oldódásához és sósav képződéséhez vezethet . Például a hideg víz lassú hozzáadása a foszfor-pentakloridhoz a következő HCl képződéséhez vezet:
PCl 5 + H 2 O → POCl 3 + 2 HClForró víz hozzáadásával lehetővé teszi, hogy több HCI hidrolizálásával PCl 5 a foszforsav . A víz és a PCl 3 foszfor-triklorid kémiai reakciója szintén HCl-t eredményez.
A tionil-klorid és víz reakciója HCl-t, valamint kén-dioxid- SO 2 -ot eredményez . A tionil-klorid vagy acil-klorid és a víz reakcióját lásd tionil-klorid és acil-klorid .
HCl generátor
Kis mennyiségű HCl készíthető laboratóriumi felhasználásra HCl-generátor alkalmazásával, különböző módszerekkel:
- felszabadulás tömény sósavból tömény kénsav alkalmazásával .
- felszabadulás tömény sósavból vízmentes kalcium- klorid alkalmazásával.
- kénsav és nátrium-klorid reagáltatásával : NaCl + H 2 SO 4 → NaHSO 4 + HCl ↑
A reagenshez általában lombikban sósavat vagy kénsavat adnak cseppenként. A sósavat száríthatjuk tömény kénsavon keresztüli buborékoltatással.
Használ
Történelmi felhasználása a hidrogén-klorid során a XX edik század közé tartozik a hidrogén-kloriddal a alkinek előállítására monomerek klórozott kloroprén és vinil-klorid , amelyeket azután polimerizáljuk , hogy polikloroprén ( neoprén ) és polivinil-klorid (PVC). A vinil-klorid előállításához az acetilén (C 2 H 2 ) HCl hozzáadásával hármas kötésen vinil-klorid keletkezik.
Az 1960-as évektől kloroprén előállítására alkalmazott "acetilén-eljárás" két acetilén- molekula reakciójával kezdődik . A kapott köztitermék HCl hozzáadásán megy keresztül a hármas kötésen, amely kloroprénhez vezet:

Az acetilén eljárást egy olyan eljárás váltotta fel, amelyben Cl 2 ad hozzá az 1,3- butadién egyik kettős kötéséhez , majd eltávolítás után kloroprént és HCl-t eredményez.
Jelenleg a hidrogén-klorid fő alkalmazásai a következők:
- többnyire sósavtermelés
- gumi hidroklórozása
- termelés a vinil-klorid és alkil-klorid
- pamut feldolgozás
- a félvezetőipar .
Egészségügyi hatások

A hidrogén-klorid sósavat képez a test szöveteivel érintkezve. Belégzése köhögést, fulladást, az orrfal, a torok és a légzőrendszer gyulladását okozhatja. A legsúlyosabb esetekben tüdőödémához , szív- és érrendszeri elégtelenséghez és halálhoz vezethet. A hidrogén-klorid súlyos szemégési és visszafordíthatatlan szemkárosodást okozhat. Csak jól szellőző helyiségben és maszkkal szabad használni.
Lásd is
Megjegyzések és hivatkozások
- HIDROGÉN-KLORID , a Kémiai Biztonság Nemzetközi Programjának biztonsági adatlapja (i) , konzultálva 2009. május 9-én
- (in) David R. LiDE, Handbook of Chemistry and Physics , Boca Raton, CRC,2008. június 16, 89 th ed. , 2736 p. ( ISBN 978-1-4200-6679-1 ) , p. 9-50
- számított molekulatömege a „ atomsúlya a Elements 2007 ” on www.chem.qmul.ac.uk .
- (en) Robert H. Perry és Donald W. Green , Perry vegyészmérnökök kézikönyve , USA, McGraw-Hill,1997, 7 -én ed. , 2400 p. ( ISBN 0-07-049841-5 ) , p. 2-50
- (a) Klotz, Irving M. / Rosenberg, Robert M., Chemical termodinamika, alapvető fogalmak és módszerek , Wiley-VCH Verlag GmbH & Co. KGaA,2008, 564 p. ( ISBN 978-0-471-78015-1 és 0-471-78015-4 ) , p. 98
- (a) W. M Haynes, Handbook of Chemistry and Physics , CRC, 2010-2011 91 th ed. , 2610 p. ( ISBN 978-1-4398-2077-3 ) , p. 14–40
- (in) David R. LiDE, CRC Handbook of Chemistry and Physics , CRC Press,2009, 90 th ed. , 2804 p. , Keménytáblás ( ISBN 978-1-4200-9084-0 )
- "Hidrogénklorid" , az ESIS-en , hozzáférés: 2009. február 19
- indexszám az 1272/2008 / EK rendelet (2008. december 16.) VI. Függelékének 3.1. Táblázatában
- " Hidrogénklorid " a vegyipari termékek adatbázisában Reptox of the CSST (quebeci szervezet, amely a munkavédelemért felelős), hozzáférés: 2009. április 25.
- „ Hidrogén-klorid ” a hazmap.nlm.nih.gov címen (hozzáférés : 2009. november 14. )
- " Hidrogén-klorid " , a francia vegyipari vállalatnál ,2016. július 4(megtekintve 2016. július 4. )







