Hidrogén-bromid
| Hidrogén-bromid | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Azonosítás | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| IUPAC név | Hidrogén-bromid | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o CAS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o ECHA | 100 030 090 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o EC | 233-113-0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Megjelenés | Sűrített gáz, cseppfolyósított, színtelen, csípős szagú. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kémiai tulajdonságok | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Brute formula |
H Br [izomerek] |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Moláris tömeg | 80,912 ± 0,001 g / mol H 1,25%, Br 98,75%, |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| pKa | -9 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dipoláris pillanat | 0,8272 ± 0,0003 D | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fizikai tulajdonságok | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T ° fúzió | -87 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T ° forráspontú | -67 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oldékonyság | vízben 20 ° C-on : 1 930 g · l -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
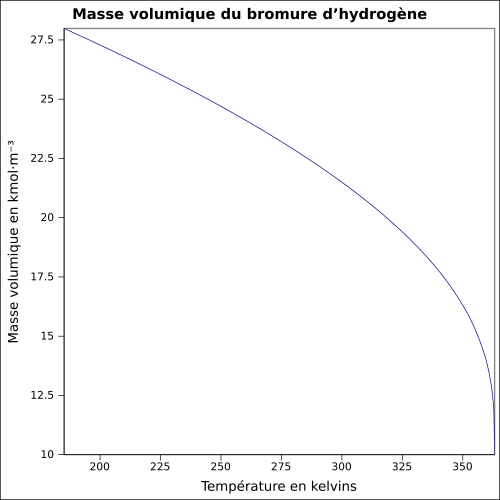
| Térfogat |
1,8 g · cm -3
egyenlet:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Telített gőznyomás | át 20 ° C-on : 2,445 kPa
egyenlet:

|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kritikus pont | 85,5 bar , 90,05 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Hangsebesség | 200 m · s -1 ( 0 ° C , 1 atm ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Termokémia | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| S 0 gáz, 1 bar | 198,7 J / mol K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Δ f H 0 gáz | –36,3 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Δ vap H ° | 12,69 kJ · mol -1 ( 1 atm , 25 ° C ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
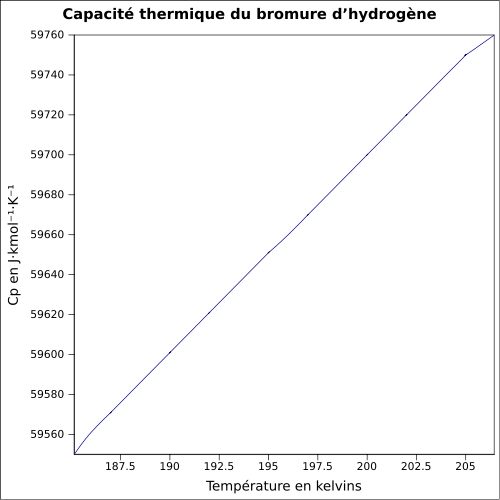
| C o | 29,1 J / mol K ( 25 ° C )
egyenlet:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Óvintézkedések | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SGH | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
   Veszély H314, H335, H314 : Súlyos égési sérülést és szemkárosodást okoz H335 : Irritálhatja a légutakat |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| WHMIS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
   A, D1A, E, A : Sűrített gáz abszolút nyomása 54,4 ° C-on = 4130 kPa D1A : Nagyon mérgező anyag, amelynek súlyos azonnali hatása veszélyes anyagok szállítása: class 2.3 E : Maró anyag veszélyes anyagok szállítása: class 8 Disclosure 1,0% szerint az összetevő közzétételi lista |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NFPA 704 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 0 3 0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Szállítás | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
1048 : VÍZTALAN HIDROGÉN-BROMID |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Belélegzés | mérgező | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bőr | Nagyon maró hatású | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Szemek | Nagyon maró hatású | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ökotoxikológia | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Szagküszöb | alacsony: 2 ppm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Egység SI és STP hiányában. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
A hidrogén-bromid , a HBr kémiai szimbólum, színtelen, mérgező és erősen maró hatású gáz , amely nedvességgel érintkezve fehér füstöt képez . Ezek a füst állnak hidrogén-bromid , amely akkor képződik, amikor a hidrogén-bromidot feloldjuk vízben . A hidrogén-bromid olyan vegyszer, amelyet széles körben használnak a kémia , az ipar vagy a laboratóriumok területén. A HBr név néha helytelenül hidrogén-bromidra utal a hidrogén- bromid gáz helyett. A kémikusok gázos vagy vízmentes hidrogén- bromidról is beszélnek , utalva hidrogén-bromidra.
Történelem
A hidrogén-bromidot Antoine-Jérôme Balard vegyész tanulmányozta és készítette, amikor a Montpellier melletti sós mocsarakban felfedezte a brómot.
Kémia
A HBr hidrogén-bromid molekula egy kova molekula, amely H hidrogénatomból és Br brómatomból áll , egyetlen kovalens kötéssel összekapcsolva . Mivel a bróm elektronegatívabb, mint a hidrogén, a kötés polarizált . Ennek eredményeként a molekula dipólusmomentumot hordoz , negatív δ- részleges töltéssel, amelyet a brómatom hordoz, és pozitív részleges töltéssel δ +, amelyet a hidrogénatom hordoz. A hidrogén-bromid ezért poláros molekula, és nagyon jól oldódik vízben és poláros oldószerekben. A hidrogén-bromid-oldatokat 68,85 tömeg% HBr-tel telítettük. Szobahőmérsékleten a hidrogén-bromid csípős szagú gáz, nedves levegőben dohányzik a hidrogén-bromid képződése miatt.
Ipari termelés
A hidrogén-bromidot iparban kis mennyiségben állítják elő a hidrogén-kloridhoz és a sósavhoz képest, amelyek a vegyipar fő termékei . A leggyakoribb előállítását HBr van keverésével dihidrogén és bróm magas hőmérsékleten ( 200 , hogy 400 ° C-on ). A reakciót általában platina katalizálja .
A hidrogén-bromid szintézise
A HBr előállítása számos módszerrel történik.
Egy nagyon egyszerű szintézis a kénsav és a nátrium-bromid reakcióját használja :
NaBr (s) + H 2 SO 4 (aq) → NaHSO 4 (s) + HBr (g)Ennek a szintézisnek azonban nincs megfelelő hozama, mert a képződött hidrogén-bromidot kénsav oxidálja dibromává :
2HBr (g) + H 2 SO 4 (aq) → Br 2 (g) + SO 2 (g) + 2H 2 O (l)Ehhez a módszerhez nem oxidáló savakat, például ecetsavat vagy foszforsavat használhatunk.
A dibrom foszforsavval vagy kén-dioxiddal történő redukciója szintén lehetővé teszi a HBr előállítását:
Br 2 + H 3 PO 3 + HO - → H 2 PO 4 - (s) + 2HBr (g) Br 2 + SO 2 + 2H 2 O → H 2 SO 4 + 2 HBr (g)Végül a fém-bromidok hidrolízise lehetővé teszi hidrogén-bromid képződését, amely egyszerűen nedves és a reakcióban jó hozammal részt vett testnyomok által szennyezett. Ez egy általánosan használt folyamat.
A hidrogén-bromid mindig bróm vízgőzöket okoz. Ezeket vörös foszforból és vízből vagy hidrogén-bromidból álló paszta távolítja el, amelyet üvegcsövek apró töredékei tesznek átjárhatóvá. Száraz és bróm nélkül a gáz már nem támadja meg a gumit.
Használ
A hidrogén-bromid számos felhasználási lehetőséget kínál a szerves termékek szintézisében .
Például alkoholokból alkil-bromidokat állítanak elő:
ROH + HBr → R + OH 2 + Br - → R-Br + H 2 OEz hozzáadódik alkének , így bromoalkanes:
RCH = CH 2 + HBr → RCH (Br) -CH 3Az alkinekhez hozzáadva brómalkéneket képeznek. Az ilyen típusú sztereokémia antiellenes :
RC≡CH + HBr → RCH (Br) = CH 2A halogén- alkénekhez adják, hogy egy geminalis dihaloalkánt képezzenek . Ez a típusú kiegészítés a Markovnikov-szabályt követi :
RC (Br) = CH 2 + HBr → RC (Br 2 ) -CH 3Hidrogén-bromidot használnak az epoxidok és a laktonok kinyitására, valamint a bróm-acetálok szintézisében is. És végül a hidrogén-bromid számos szerves reakció katalizátora .
Biztonság
A hidrogén-bromid a legtöbb fémmel nedvesség jelenlétében reagál, hidrogént , nagyon gyúlékony gázt képezve . A bázisokkal való reakció nagyon heves lehet. Vízzel reagálva hidrogén-bromidot , erős savat képez . Ezt a terméket nem szabad a környezetbe engedni, mert ez megváltoztatja a víz pH-ját. Vízzel keverve gyors korróziót okoz . A hidrogén-bromid a levegőnél nehezebb gáz, és felhalmozódhat a föld alatt vagy zárt térben. Párás légkörben fehér gőzök szabadulnak fel.
Külső linkek
Lásd is
Hivatkozások
- HIDROGÉN-BROMID , a Kémiai Biztonság Nemzetközi Programjának biztonsági adatlapja (i) , konzultálva 2009. május 9-én
- (in) David R. LiDE, Handbook of Chemistry and Physics , Boca Raton, CRC,2008. június 16, 89 th ed. , 2736 p. ( ISBN 978-1-4200-6679-1 és 1-4200-6679-X ) , p. 9-50
- számított molekulatömege a „ atomsúlya a Elements 2007 ” on www.chem.qmul.ac.uk .
- (en) Robert H. Perry és Donald W. Green , Perry vegyészmérnökök kézikönyve , USA, McGraw-Hill,1997, 7 -én ed. , 2400 p. ( ISBN 0-07-049841-5 ) , p. 2-50
- " Különböző gázok tulajdonságai ", a flexwareinc.com címen (hozzáférés : 2010. április 12. )
- (a) W. M Haynes, Handbook of Chemistry and Physics , CRC, 2010-2011 91 th ed. , 2610 p. ( ISBN 978-1-4398-2077-3 ) , p. 14–40
- (in) David R. LiDE, CRC Handbook of Chemistry and Physics , CRC Press,2009, 90 th ed. , 2804 p. , Keménytáblás ( ISBN 978-1-4200-9084-0 )
- Index szám táblázat 3.1 függelék VI EK rendelet 1272/2008 (december 16, 2008)
- " Hidrogén-bromid " a vegyi termékek adatbázisában Reptox of the CSST (quebeci szervezet, amely a munkavédelemért felelős), hozzáférés: 2009. április 23.
- " Hidrogén-bromid " a hazmap.nlm.nih.gov címen (hozzáférés : 2009. november 14. )