Etanol
| Etanol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
  Etanol molekula |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Azonosítás | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| IUPAC név | Etanol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Szinonimák |
etil-alkohol |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o CAS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o ECHA | 100 000 526 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o EC | 200-578-6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ATC kód | D08 , V03 , V03 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| DrugBank | DB00898 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PubChem | 702 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ChEBI | 16236 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o E | E1510 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| FEMA | 2419 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mosolyok |
CCO , |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| InChI |
InChI: InChI = 1 / C2H6O / c1-2-3 / h3H, 2H2,1H3 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Megjelenés | jellegzetes szagú színtelen folyadék. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kémiai tulajdonságok | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Brute formula |
C 2 H 6 O [Az izomerek] |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Moláris tömeg | 46,0684 ± 0,0023 g / mol C 52,14%, H 13,13%, O 34,73%, |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dipoláris pillanat | 1,66 D | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molekuláris átmérő | 0,469 nm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fizikai tulajdonságok | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T ° fúzió | -114 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T ° forráspontú | 79 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oldékonyság | vízben: keverhető, Poláros és nem poláros oldószerekben ( aceton , dietil-éter ) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oldhatósági paraméter δ |
26,0 MPa 1/2 ( 25 ° C ); 11,2 cal 1/2 · cm -3/2 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Térfogat |
0,789
egyenlet:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Öngyulladási hőmérséklet |
423 , hogy 425 ° C ; 363 ° C (a forrásoktól függően) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Lobbanáspont | zárt csésze: 13 ° C tiszta 17 ° C-on 95 térfogat% . 21 ° C-on 70 térfogat% . 49 ° C-on 10 térfogat% . 62 ° C-on 5 térfogat% . |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Robbanási határok a levegőben | Alsó: 3,3 térfogatszázalék Felső: 19 térfogatszázalék |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Telített gőznyomás | át 20 ° C-on : 5,8 kPa
egyenlet:
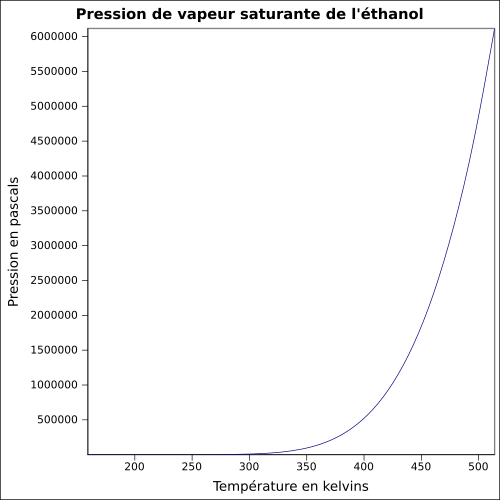
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dinamikus viszkozitás | 1,20 × 10 -3 Pa s át 20 ° C-on | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kritikus pont | 240,85 ° C , 6,14 MPa , 0,168 l mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Hangsebesség | 1162 m s -1 át 20 ° C-on | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Termokémia | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| S 0 folyadék, 1 bar | 159,86 J · mol -1 · K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Δ f H 0 gáz | −235,3 kJ mol −1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Δ f H 0 folyadék | −277,0 kJ mol −1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| C o |
111 J · K -1 · mol -1
egyenlet:
egyenlet:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PCS | 1 366,8 kJ · mol -1 (folyékony) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronikus tulajdonságok | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1 re ionizációs energia | 10,43 ± 0,05 eV (gáz) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kristályográfia | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kristályosztály vagy űrcsoport | Pc | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Hálóparaméterek |
a = 5,377 Å b = 6,882 Å |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Hangerő | 298,57 Å 3 sűrűség = 0,7893 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Optikai tulajdonságok | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Törésmutató | 1.3594. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Óvintézkedések | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SGH | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
  Veszély H225, P210, P305 + P351 + P338, P370 + P378, P403 + P235, H225 : Tűzveszélyes folyadék és gőz P210 : Hőtől / szikrától / nyílt lángtól / forró felületektől tartsa távol. - Tilos a dohányzás. P305 + P351 + P338 : Ha a szembe jut: Óvatosan öblítse le vízzel néhány percig. Távolítsa el a kontaktlencséket, ha az áldozat viseli őket, és könnyen eltávolíthatók. Öblítse tovább. P370 + P378 : Tűz esetén: Használja a… oltást. P403 + P235 : Jól szellőző helyen tárolandó. Maradj laza. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NFPA 704 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3 2 0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Szállítás | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
33 : nagyon gyúlékony folyadék (lobbanáspont 21 ° C alatt ) ENSZ-szám : 1170 : ETIL-ALKOHOL, több mint 24 térfogatszázalék etanolt tartalmaz; ETIL-ALKOHOL-OLDAT, amely több mint 24 térfogatszázalék etanolt tartalmaz; Etanol, több mint 24 térfogatszázalék etanolt tartalmaz; vagy több mint 24 térfogatszázalék etanolt tartalmazó etanololdat Osztály: 3 Címke: 3 : Gyúlékony folyadékok Csomagolás: II . csomagolási csoport : közepesen veszélyes anyagok;  |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| IARC osztályozás | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1. csoport: Emberre rákkeltő | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Belélegzés | mérgezés, hányinger, hányás | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bőr | hatástalan | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Szemek | veszélyes | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Lenyelés | mérgezés, hányinger, hányás, etil kóma (ami halálhoz vezethet) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ökotoxikológia | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| DL 50 | 5-20 g kg -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CL 50 | 20 000-30 000 ppm 4-6 órán át | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LogP | -0,32 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Szagküszöb | alacsony: 49 ppm magas: 716 ppm |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Farmakokinetikai adatok | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Anyagcsere | a májban etanálban, majd ecetsavban , óránként ~ 100 mg kg -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pszichotróp jelleg | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kategória | Depresszáns | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fogyasztás módja |
Lenyelés |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Más nevek |
Alkohol (lásd Alkoholos italok ) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| A függőség kockázata | Diák | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Egység SI és STP hiányában. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Az etanolt, illetve etil-alkohol (vagy egyszerűbben alkohol ) egy alkoholt a szerkezeti képlet CH 3 -CH 2 -OH. Színtelen folyadék, illékony , gyúlékony és vízzel minden arányban elegyedik . Ez egy pszichotróp gyógyszer és az egyik legrégebbi rekreációs drogok formájában egy alkoholos italt . Az etanolt az élelmiszeripar használja ( különösen szeszes italok előállításához ), az illatszeriparban és a gyógyszeriparban ( oldószerként ), valamint a bioüzemanyagokban ( bioetanol ). Alkohol hőmérőkben is használják .
Képlet
Az etanol két szénatomos primer alkohol , amelynek nyers C 2 H 6 O képleteés a félig-szerkezeti képlete CH 3 CH 2 OHvagy CH 3 -CH 2 -OH, Jelezve, hogy a szén-dioxid a -metil -csoport (CH 3 -) Kapcsolódik a metándiil- csoport (-CH 2 -) maga kapcsolódik a hidroxilcsoporthoz (-OH). Ez egy alkotmány izomer a -metil-éter . Etanol általában által kijelölt rövidítés „EtOH”, az etil- csoport, (C 2 H 5 -) a szerves kémiában gyakran "And" rövidítéssel rendelkezik .
Vezetéknév
Etanol a szisztematikus neve által meghatározott Szerves vegyületek nómenklatúrája egy molekula két szénatommal (prefix et- ), amelynek egyetlen kötést közöttük (utótagot -ane ), és kapcsolódik egy hidroxil- csoportot (utótag -ol ).
Történelem
A fermentáció a cukrok etanollá az egyik legrégebbi biotechnológia használják az emberek, különösen a szeszipar és már használják, mivel a történelem előtti időkben , így az alkoholtartalmú italok . Kémiai elemzések szerves vegyületek abszorbeált üvegekbe ből származó újkőkorban talált egy falu a tartomány Henan a Kínában , kiderült, hogy keverékei erjesztett italok álló rizs, méz és gyümölcs állítottunk elő a VII th évezred ie. Kr . U.
Bár a desztilláció olyan technika ismert alkimisták Greco-egyiptomi (például zószimosz ), az első írásos feljegyzések a termelés az alkohol a bor megy vissza csak XII th században a munka az alkimisták a School of Medicine Salerno . Az első említés a különbséget abszolút alkohol és a víz-alkohol elegyek tűnik, hogy a XIII edik században a Raymond Lully . Megjegyezzük azonban, hogy a tanult perzsa Rhazes izolálták etanol az aktuális X edik században.
A 1796 , Johann Tobias Löwitz kapott tiszta etanollal szűrésével desztillált etanolban keresztül aktív szén . Antoine Lavoisier meghatározza, hogy az etanol áll szén , az oxigén és a hidrogén , valamint a 1808 , Nicolas Theodore de Saussure meghatározza annak nyers képlet . A 1858 , Archibald Scott Couper közzé a kémiai szerkezete az etanol, amely egyike volt az első struktúrák meghatározva.
Az etanolt először szintetikusan előállított in 1826 A független munkája Georges Serullas a franciaországi és Henry Hennel az Egyesült Királyságban . A 1828 , Michael Faraday szintetizált etanolt a savkatalizált hidratálást az etilén , a szintézist hasonló az ipari eljárás ma is használatos.
Az etanolt a lámpák üzemanyagaként , az 1930-as évekig pedig autók üzemanyagaként is használták . Például a Ford T tiszta etanollal 1908 - ig működhetett .
Természetes jelenlét
Az etanol illékony melléktermék az élesztő anyagcsere . Tehát jelen van ezen organizmusok élőhelyén és légkörünkben. Érett gyümölcsök bocsátják ki, és sok növényben természetes csírázási anaerob körülmények miatt, vagy amikor oxigénhiányos növények (például áradás esetén) energiát nyernek a fermentációból.
A 2000-es évek elején a légköri ciklusát még mindig rosszul értették. Számszerűsíteni kívánjuk a növények és élesztők által kibocsátott etanolt, annak légköri szintjét és átalakulási sebességét a levegő hidroxilján keresztül ( metil-kloroform titrálásával ). Az első durva becslés szerint az üzemek etanol-kibocsátási aránya 10 és 38 Tg / év között volt, vagyis jelentős mértékben hozzájárult a légkörbe évente becsült összes etanol becsléséhez (évente 25 és 56 Tg között. Ezután egy új munka az üzemek kibocsátását felülemelte: 70 Tg / év (50-90 Tg / év), a levegőből beáramló etanol mintegy 75% -a a valóságban elpusztult a hidroxilcsoportokkal száraz vagy nedves levegőben történő reakcióval. A száraz földön száraz és nedves lerakódások is léteznek.
Az etanolt az űrben is kimutatták , amely szilárd formában porszemeket borított a csillagközi felhőkbe .
Fizikai-kémiai tulajdonságok
Az etanol illékony , színtelen folyadék, amelynek szaga van. Égése füstmentes és kékes lángot ad. Az etanol fizikai-kémiai tulajdonságai elsősorban a hidroxilcsoport és a rövid szénlánc jelenlétéből származnak . A hidroxilcsoport hidrogénkötéseket képezhet , ezáltal az etanol viszkózusabb és kevésbé illékony, mint az ekvivalens molekulatömegű szerves oldószerek . Az etanol törésmutatója magasabb, mint a vízé (1,3594 25,0 ° C-on ). A hármas pont etanol figyelhető meg -123,15 ° C irányuló nyomás 4,3 × 10 -4 Pa .
Tulajdonságok oldószerként
Az etanol poláros protikus oldószer . Sok szerves oldószerrel elegyedik , például klórozott oldószerekkel ( szén-tetraklorid , kloroform , triklór-etán , tetraklór-etilén ), alifás szénhidrogénekkel ( pentán , hexán ), aromás oldószerekkel ( benzol , toluol , piridin ), ecetsavval , acetonnal , dietil-éterrel. , az etilén-glikol vagy a nitrometán . Azonban, keverhetőségén etanolban alifás szénhidrogének általában csökken a növekedés a hossza a szénlánc az alkán és a hőmérséklet csökkenése, a határ elegyednek amely például 13 ° C-on a dodekán. .
A hidroxilcsoport poláris jellege miatt az etanol ionos vegyületeket is feloldhat , például nátrium- és kálium- hidroxidokat , magnézium- , kalcium- és ammónium-kloridokat, vagy ammónium- és nátrium- bromidokat . A nátrium- és kálium- klorid csak alig oldódik etanolban.
Az etanol nem poláros része lehetővé teszi a hidrofób anyagok , különösen az illóolajok és számos szagos, színező és gyógyászati vegyület oldását.
Etanol lehet használni, mint egy oldószert sok kémiai reakciók során szintézisek , mint például a nukleofil S N 1 szubsztitúciókat , közben katalitikus hidrogénezések során aldol reakciók során Wittig-reakciókban , során Diels reakciók. Alder vagy alatt diazotálási reakciókkal .
Az etanol közömbös a mindennapi élet szinte minden lágyított felülete, a lakkok (a cellulózlakkok és a sellakkal nem rendelkező lakkok kivételével ), az akril- és gliceroftalikus festékek felé, miközben nagyon jó oldószer. Ezáltal széles körben alkalmazott tisztító oldószer önmagában vagy más vegyületekkel keverve.
Keverhetőség vízzel
A víz-etanol keverékek kisebb térfogatot foglalnak el, mint a két komponens térfogatának összege. Térfogat víz és térfogat etanol keverékével például ekvivalens térfogatú 1,92-ot kapunk. A víz és az etanol keverésének reakciója exoterm , és 24,85 ° C-on 777 J mol -1-ig szabadulhat fel. Az etanol poláris jellege higroszkóppá teszi , annyira, hogy tiszta, elnyeli a levegő nedvességét.
Egy azeotrop képződik vízzel 89,47 mol% etanolt és 10,53 mol% víz atmoszferikus nyomáson . A forráspontja etanol 78,4 ° C és 100 ° C-on a víz, de a azeotróp elegy forr át 78,2 ° C-on , amely a forráspontja alatti pontok az egyes. Összetevőket. Az azeotrop keverék aránya a nyomás függvényében változik.
| Nyomás | Forráspont | Etanol moláris frakció |
|---|---|---|
| 0,1 MPa | 78,35 ° C | 0,894 |
| 0,344 MPa | 112,6 ° C | 0.882 |
| 0,689 MPa | 135,7 ° C | 0,874 |
| 1,378 MPa | Olvadáspont: 164,2 ° C | 0,862 |
| 2 068 MPa | Op .: 182,6 ° C | 0,852 |
Néhány százalék etanol hozzáadása a vízhez drasztikusan csökkenti a víz felületi feszültségét . Ez a tulajdonság segít megmagyarázni a jelenséget bor könnyek . Amikor egy pohárban kavargatja a bort, az etanol gyorsabban elpárolog a vékony filmben az üveg oldalai mentén. Az etanol aránya csökken, így a felületi feszültség növekszik, és a film cseppekké alakul. Ezt a jelenséget Marangoni-effektusnak hívják , és James Thomson 1855- ben írta le és magyarázta meg .
Az alkoholtartalom , más néven alkoholtartalom a keverékben lévő alkohol térfogatának és a keverék teljes térfogatának a 20 ° C-ra való aránya . Arra használják, hogy meghatározzák az alkohol, vagyis az etanol arányát egy alkoholtartalmú italban . A titer kifejezésére használt egység a térfogatrész (térfogat%) vagy a fok (megjegyzés: "°").
Víz-etanol keverékek, amelyek több, mint 50% etanolt tűzveszélyes át szobahőmérsékleten , hanem egy keveréket, amely kevesebb, mint 50% etanolt gyulladásra. A főzési technika ezt a tulajdonságot használja . A forró serpenyőben hozzáadott alkohol lángokban ég és összetett reakciót ad. Az égő alkohol hőmérséklete ekkor meghaladhatja a 240 ° C-ot, és a jelenlévő cukrok karamellizálódásához vezet .
Termelés
Etanol lehet iparilag a petrolkémiai által hidratációja a etilén , és az alkoholos erjedés az élesztők vagy cellulóz . A leggazdaságosabb folyamat főként az olajpiacon múlik .
Közvetlen katalízis
Ez az 1970-es években kifejlesztett folyamat teljesen kiszorította az egyéb termelési módszereket. Az így előállított etanolt az ipar nyersanyagként vagy oldószerként használja . A tej petrolkémiai , használva hidratációs által savas katalízissel a etilén , a reakciót követően:
H 2 C = CH 2+ H 2 O↔ CH 3 CH 2 OHA leggyakrabban alkalmazott katalizátor a foszforsav , amely porózus hordozón , például szilikagélen vagy celiten adszorbeálva van . A nyomás növekedése elősegíti az egyensúly elmozdulását az etanol előállítása felé, a Le Chatelier elvét követve , ezért az egyensúly gyors eléréséhez nagy vízgőznyomás alatt álló katalizátort kell használni . A végső termék egy víz-etanol elegyben tartalmazó között 10 % m és 25 % m- etanolt.
Közvetett katalízis
Egy korábbi folyamat, de mára elavult, kialakult az 1930-as években a Union Carbide , és fogják használni sokkal a XX th században . A etilén van észterezett által kénsavat termelni etil-szulfát- , amelyet azután hidrolizálunk , így az etanol és a kénsav, amely így arra szolgál, mint egy katalizátor ebben a reakcióban:
H 2 C = CH 2+ H 2 SO 4→ CH 3 CH 2 SO 4 H CH 3 CH 2 SO 4 H+ H 2 O→ CH 3 CH 2 OH+ H 2 SO 4Ez a folyamat nagy mennyiségű kénsavat fogyaszt, és alapanyagként jó minőségű gázkeveréket igényel.
Erjesztés
Az alkoholos italokban használt etanolt alkoholos erjesztéssel állítják elő . Hasonlóképpen, a legtöbb bioetanol cukornövények , például répa és cukornád , vagy gabonafélék, például kukorica és búza fermentációs kezeléséből származik . Bizonyos típusú élesztőgombák , például a Saccharomyces cerevisiae , a cukrokat etanollá és szén-dioxiddá metabolizálják , a következő reakciókat követve:
C 6 H 12 O 6→ 2 CH 3 CH 2 OH+ 2 CO 2 C 12 H 22 O 11+ H 2 O→ 4 CH 3 CH 2 OH+ 4 CO 2A fermentáció az élesztőgomba kedvező körülmények között tenyésztjük, hogy készítsen az alkohol, hőmérsékleten, körülbelül 35 és 40 ° C-on . A legellenállóbb élesztőtörzsek körülbelül 15 térfogat% etanol koncentrációban képesek fennmaradni . Az etanol élesztőre gyakorolt toxicitása korlátozza az alkohol koncentrációját, amelyet sörkészítéssel lehet elérni , magasabb koncentrációkat pedig mutációval vagy desztillációval lehet elérni . Az erjedés során a borostyánkősavból , az ecetsavból és az amil-alkoholból másodlagos termékek képződnek, például glicerin .
Ahhoz, hogy keményítőből etanolt állítson elő , például gabonamagvakból, először cukrokká kell átalakítani. Amikor sör sör, a magot hagyjuk csírázni ( malátázás ), amely lehetővé teszi a termelés bizonyos enzimek, mint például a cytases , amilázok , foszfatázok vagy peptidázok , szükséges cukrosítás keményítő. A bioetanol esetében ez a folyamat felgyorsítható kénsav vagy gombákból előállított amiláz alkalmazásával .
Cellulóz-etanol
A fermentáció is nyert cellulóz , de egészen a közelmúltig a költségek celluláz , egy enzim lebontja a cellulóz, nem tette lehetővé az ipar fejlődése iparilag. A 2004 , a kanadai vállalat Iogen Corporation építette az első növény alapuló etanol termelésére cellulóz. Ennek a technológiának a fejlesztése lehetővé teheti a mezőgazdaságból származó számos cellulóz tartalmú növényi hulladék, például fűrészpor vagy szalma felhasználását és újrafeldolgozását . Más biotechnológiai vállalatok jelenleg olyan gombákat fejlesztenek ki, amelyek képesek nagy mennyiségű celluláz és xilanáz előállítására, annak érdekében, hogy más mezőgazdasági maradványokat cellulózzá alakítsanak, például kukoricahulladékot vagy cukornádból származó bagassot .
Tisztítás
A különféle etanol-előállítási eljárások víz-etanol keverékeket állítanak elő. Az iparban vagy üzemanyagként történő felhasználáshoz az etanolt meg kell tisztítani. A frakcionált desztilláció tud koncentrálni etanol 95,6 térfogat% (89,5 mol% ) és formák keverékét azeotrop vízzel, amelynek forráspontja az 78,2 ° C . Az abszolút etanol előállításának szokásos módszerei közé tartozik a szárítószerek , például keményítő , glicerin vagy zeolitok , azeotrop desztilláció és extraktív desztilláció alkalmazása .
Etanol tulajdonságok
Különböző minőségű etanolok állnak rendelkezésre különböző felhasználásokra:
- a denaturált alkohol tipikusan etanol, amelyet denaturálószerrel adnak hozzá, hogy helytelen keveréket hozzanak létre az élelmiszer-fogyasztáshoz. Az alkalmazott denaturálószerek lehetnek izopropil-alkohol , metanol , dietil-ftalát , tiofén , dietil-éter vagy természetes gáz kondenzátumok . Takarításra, tisztításra, fertőtlenítésre és alkoholos kályhákban használják . Egy asztalos oldószerét annak sellak lakkok , ez is egy zsíroldó az iparban, értékelik a toxicitása alacsony a bőrön. Általában 95 térfogatszázalék ;
- a metilezett szesz etanol és metanol keveréke . Denaturált szesz igen toxikus jelenléte miatt metanol (általában 5 és 10 térfogat% ). Ablakok és műanyag felületek tisztítására szolgál;
- A helyesbített alkohol egy desztillátum mérési 70-96 térfogat% etanolt módszerrel frakcionált desztillációval . A nyers alkohol desztillálásával elérhető maximális koncentráció 96 térfogatszázalék a víz-etanol azeotróp képződése miatt . Likőrök vagy vodkák készítésére használják , de háztartási karbantartásra, tisztításra vagy fertőtlenítésre is;
- az abszolút etanol az etanol, amely legfeljebb 1% vizet tartalmaz, de a kémia legfontosabb szállítóinak többsége az abszolút etanol- etanol 99,8% -os elnevezését adja el. Oldószerként használják laboratóriumi és ipari alkalmazásokhoz, valamint üzemanyagként;
- vízmentes etanol az az etanol, amelyből a vizet a lehető legnagyobb mértékben eltávolították. Például az abszolút etanol fémes magnéziummal történő reakciója, majd atmoszferikus nyomáson történő desztillálás után 50 ppm víz (0,005 tömeg% víz vagy 1/20 000) etanolt eredményez . Ez az etanolfok lehetővé teszi, hogy nedvességre érzékeny reakciókban alkalmazzák.
Reakciókészség és reakciók
Az etanol egy primer alkohol , és egy gyenge sav ( p K a = 15,5), amelynek konjugált bázis van etanolát . A nem oxigént kötő dublettek reakciókészsége miatt jó nukleofil is . Reakciókészsége, főleg a hidroxilcsoport jelenléte miatt, dehidratációs , dehidrogénezési , oxidációs és észteresítési reakciókat foglalhat magában .
Sav-bázis kémia
Az etanol semleges molekula, és az etanol vizes oldatának pH-ja 7,00. Az etanolt kvantitatív módon átalakíthatjuk konjugált bázissá , az etanolát- ionná egy alkálifémmel , például nátriummal reagáltatva :
2 CH 3 CH 2 OH+ 2 Na→ 2 CH 3 CH 2 ONa+ H 2vagy erős bázissal , például nátrium-hidriddel :
CH 3 CH 2 OH+ NaH→ CH 3 CH 2 ONa+ H 2Esterifikáció
Az etanol reagál karbonsavakkal, erős sav jelenlétében ( katalízis ), etil- észtereket és vizet kapva a következő reakció szerint:
RCOOH+ CH 3 CH 2 OH→ RCOOCH 2 CH 3+ H 2 OEz a reakció reverzibilis, és az egyensúly lassan alakul ki, savas savas katalizátorok , például kénsav , sósav , bór-trifluorid vagy paratoluol-szulfonsav alkalmazását igényli . A megfelelő hozam elérése érdekében ehhez a nagyüzemi iparban alkalmazott reakcióhoz szükség van a víz eltávolítására a reakcióelegyből, amint kialakul. Az etanol szervetlen savakkal észtereket is képezhet, és lehetővé teszi a szerves szintézisben széles körben alkalmazott vegyületek , például dietil-szulfát (C 2 H 5 ) 2 SO 4 előállítását.vagy trietil-foszfátot (C 2 H 5 ) 3 PO 4. A nitrit etil- CH 3 CH 2 O-N = Ohasonlóan előállítható etanolból és nátrium-nitritből , és általában vizelethajtóként vagy orvosság ellen használják az influenza vagy a nátha kezelésére , mielőtt az 1980-as évek elején kivonták volna a piacról .
A elszappanosítási reakció , amely lehetővé teszi, etanolból megreformálják etilészterek jelenlétében egy sav vagy egy bázis, így egy karboxilát , alkalmazunk előállítására szappanok .
Kiszáradás
A használata erős savak is lehetővé teszik az etanol lehet dehidratált alkotnak dietil-étert , és több tonna dietil-éterrel gyártanak évente használva kénsavat , mint egy katalizátor . A reakció a következőképpen írható le:
2 CH 3 CH 2 OH→ CH 3 CH 2 OCH 2 CH 3+ H 2 O( 120 ° C-on )Az etilén a fő termék, ha a hőmérséklet meghaladja a 160 ° C-ot :
CH 3 CH 2 OH→ H 2 C = CH 2+ H 2 OÉgés
Az etanol elégetése füst és kékes lángot ad. Az égési reakció szén-dioxidot és vízgőzt képez :
CH 3 CH 2 OH( L ) + 3 O 2( G ) → 2 CO 2( G ) + 3 H 2 O( G )A fűtőérték (Δ c H °) etanol égés 1366,8 kJ mol -1 át 25 ° C-on , és a specifikus hőkapacitása (C V ) van 2.438 kJ kg -1 K -1 .
Oxidáció
Az etanol katalizátorok jelenlétében történő oxidálása (vagy dehidrogénezése ) lehetővé teszi etanál (vagy acetaldehid ) előállítását a következő reakció szerint:
CH 3 CH 2 OH→ CH 3 CHO+ H 2A máj hepatocitáiban az alkohol-dehidrogenáz enzim hasonlóan átalakítja az etanolt etanallá. Az Ethanal mérgezőbb, mint az etanol, és számos másnapossági tünetért felelős lehet , bár a tünetek során nincs jelen a vérben. Az agyban az alkohol-dehidrogenáznak kisebb szerepe van az etanol etanálné történő átalakításában, és elsősorban a kataláz enzim katalizálja ezt a reakciót.
A végső szakaszában alkoholos erjedés vonja az átalakítás a piruvát , hogy etanal enzim által piruvát -dekarboxiláz , majd csökkentése (vagy hidrogénezéssel ) a etanal etanollá enzim által alkohol-dehidrogenáz , ebben az esetben katalizálására ellentétes reakciót. Mint endogén metabolit, az etanal mérgező és feltételezhetően rákkeltő. Károsítja a vérképző őssejteket (felelős a vér folyamatos megújulásáért ); egyrészt e sejtek kettős szálú DNS-jében bekövetkező törések forrása (ami elősegíti hanyatlásukat és kromoszóma-átrendeződéseket hoz létre ), másrészt megakadályozza e károsodás megfelelő helyreállítását ( 53. o. ). rosszindulatú daganatokat okoz.
Halogénezés
Az etanol hidrogén-halogenidekkel reagálva halogén- alkánokat , például klór-etánt és bróm- etánt állít elő S N 2 reakcióval :
CH 3 CH 2 OH+ HCl→ CH 3 CH 2 Cl+ H 2 OEhhez a reakcióhoz katalizátor , például cink-klorid alkalmazása szükséges . Az alkil-halogenidek szintetizálhatók halogénező szerekkel , például tionil-kloriddal vagy foszfor-tribromiddal is :
CH 3 CH 2 OH+ SOCl 2→ CH 3 CH 2 Cl+ SO 2+ HClHaloform reakció
A haloform reakció egy kémiai reakció , amely a szintetizálására trihalogén , mint például a kloroform (CHCI 3), Bromoform (CHBr 3) vagy jodoform (CHI 3), és az egyik legrégebbi ilyennek leírt szerves reakció. A 1822 , Georges Serullas számolt a reakciót etanolban diodine és nátrium-hidroxid vízben, alkotó nátrium-formiát és jodoform , majd az úgynevezett „szén-hidrojodid”.
Az etanol a nátrium-hipoklorittal reagálva kloroformot kap a következő szintézis szerint:
CH 3 CH 2 OH+ NaClO→ CH 3 CHO+ NaCl+ H 2 O CH 3 CHO+ 3 NaOCl→ CCl 3 CHO+ 3 NaOH CCl 3 CHO+ NaOH→ kloroform 3+ HCO 2 NaHasonlóképpen, bróm- és jodoformot nyerünk nátrium-hipobromitból és nátrium-hipo-joditból. Az etanol az egyetlen elsődleges alkohol, amely lehetővé teszi ezt a reakciót.
használat
Üzemanyag
A világszerte előállított etanolt elsősorban üzemanyagként használják . Az etanol mennyisége változhat néhány százalékkal a benzin a Nyugat-Európában , hogy 95 térfogat% -ban benzin Brazíliában , ahol a 90% -a új járművek használja a rugalmas üzemanyag technikát és futtatható ezt a keveréket. Az üzemanyagként felhasznált etanol több mint 66% -a alkoholos erjesztésből származik .
A Franciaországban forgalmazott E85 üzemanyag 65–85% bioetanolt tartalmaz, a többi benzin; az arány télen 65% és 75% között változik, nyáron pedig eléri a 85% -ot.
A vízhez kapcsolódóan sok repülőgép ( belső égésű motorok ) és rakéták üzemanyaga volt a második világháború idején azoknak az országoknak, ahol kevés a kőolajkészlet.
Franciaországban a földterület 1% -át bioetanolnak szánják. Az évente Franciaországban előállított tizennyolc millió hektoliterből tizenkét milliót használnak fel bioüzemanyagok előállítására, amelynek 30% -át Franciaországon kívül forgalmazzák. A Franciaországban bioüzemanyagnak szánt nyolcmillió hektoliter bioetanolból egymilliót (vagyis 12% -ot) használnak az E85 üzemanyagai . Kis mennyiségű etanolt használnak az ED95 gyártásához (95% bioetanol és 5% pro-cetán adalék) kifejezetten motorizált nehéz tehergépjárművekhez (beleértve az autóbuszokat is).
Alkoholos italok
Az alkoholos italok etanoltartalma (vagy alkoholfoka ) az előállítási módtól és az alapanyagtól függően változik. A legtöbb alkoholtartalmú ital az erjesztett italok és a szeszes italok közé sorolható . A fő erjesztett italok vannak a sörök , előállított gabona vagy más előállító üzemek keményítő , borok és az almabor , előállított gyümölcslé és mézbor , előállított méz . A szeszes italokat erjesztett italok desztillálásával állítják elő . Különböző szeszes italokat különböztethetünk meg , mint például a whiskyt , erjesztett gabonafélék magjából desztillálva, eaux-de-vie , erjesztett gyümölcsléből desztillálva, vagy rumot , melaszból vagy cukornádléből desztillálva . Sok Eaux-de-vie és likőrök is elő infúzió gyümölcsök, gyógynövények és fűszerek, szeszes italok , mint a gin ami által létrehozott infúzió boróka bogyó a finomított alkohol .
Más módszerek alkalmazhatók az alkoholszint növelésére , például a frakcionált megszilárdulás , amelyet az alma levéből applejack készítésére használnak . A dúsított bort úgy állítják elő, hogy az életvízhez vagy más szeszekhez hozzáadják a részben erjesztett bort, amely módszer az élesztőket elpusztítja, miközben a cukrok egy része megmarad.
Az alkoholos italokat a főzés során használják illatuk miatt, és azért, mert az alkohol feloldja a hidrofób szagú vegyületeket . Az ezekből az italokból származó etanolt ecet előállítására is használják, ugyanúgy, mint az ipari etanolt ecetsav előállítására .
Nyersanyag
Az etanol a vegyiparban fontos szintetikus köztitermék . Különösen etil- halogenidek , etil- észterek, etil- aminok , dietil-éter , ecetsav és kisebb mértékben butadién előállításánál alkalmazzák .
Fertőtlenítő
Az etanolt az orvosi területen használják borogatásban, antiszeptikumként . Körülbelül 60 térfogatszázalékos koncentrációjú hidroalkoholos oldatokban is használják . Az etanol megöli az organizmusokat fehérjék denaturálásával és lipidjeik oldásával . Hatékony a legtöbb baktérium és gomba , sok vírus ellen, de a spórák ellen hatástalan .
Oldószer
Az etanol vízzel elegyedik és jó oldószer . Megtalálható festékekben , ipari színezékekben, hagyományos lakkokban, alkoholtartalmú italokban , markerekben és kozmetikumokban , például parfümökben és dezodorokban .
Orvosi felhasználás
Az abszolút etanolt néha injektálják a daganatokba , hogy nekrózisukat okozzák . Nincs azonban célzott tevékenysége, mivel válogatás nélkül az egészséges és a rákos szövetek nekrózisát okozza.
Az etanolt metanol vagy etilén-glikol mérgezés kezelésére is használják . Ezekben az esetekben az etanol versenyben áll más alkoholokkal, hogy az alkohol-dehidrogenáz enzim metabolizálja őket , csökkentve ezzel az aldehidekké és karbonsavakká történő metabolizmusuk eredményeként keletkező mérgező származékokat , és csökkentve a kalcium-oxalát ( etilén-glikolból) kristályosodása következtében fellépő toxikus hatásokat. ) a vesékben .
Történelmi felhasználások
A modern gyógyszerek kifejlesztése előtt az etanolt különféle orvosi célokra használták, ideértve a depresszió kezelését és érzéstelenítőként . Az is ismert, hogy igazságszérumként szolgálhat .
Ennek az üzemanyag , azt használják a rakétamotorokban kombinálva folyékony oxigén . A második világháború alatt a német " V2 " rakéta 25 térfogat% vízzel kevert etanolt használt az égéstér hőmérsékletének csökkentésére . Az amerikai " PGM-11 Redstone " ballisztikus rakéta , amelyet a német V2 kialakítása ihletett, folyékony oxigénnel kevert etanolt is használt . A rakéták és rakéták alkoholalapú tüzelőanyagai később üzemen kívül kerültek, mivel új üzemanyagokat fejlesztettek ki.
Gyógyszertan
Az etanol metabolizmusának két fő útja a májban az alkohol-dehidrogenáz és az oxidációs rendszer mikroszomális etanol (in) . Alacsony etanol-koncentráció esetén az alkohol-dehidrogenáz az etanolt acetaldehiddé oxidálja , de nagyobb koncentrációban, vagy ismételt etanol-dózis esetén a mikroszómális etanol-oxidációs rendszer dominál.
Az Európai Gyógyszerkönyvben az „etanol” vízmentes etanolt jelöl, vagyis 100% -os tisztaságot, szemben a gyógyszertárakban található 95 % -os vagy 70 % -os etanollal . Ehhez jön még a minőségi „alkohol Ph. Eur. "(Az Európai Gyógyszerkönyv esetében ), amely az etanol olyan minőségét jelöli, amelyhez számos nyomot és szennyeződést számszerűsítettek.
Fiziológiai tulajdonságok
Az alkoholos italoknak különböző hatásai vannak , az alkoholizmus az etanoltartalmú italok túlzott fogyasztása, amely függőséghez vezet, amely az etanolt kábítószerként osztályozza. Ez lenne a legkárosabb gyógyszer a társadalmak számára.
| Véralkoholszint ( g · l –1 ) |
Alkoholszint ( térfogat% ) |
Tünetek |
|---|---|---|
| 0.5 | 0,05 | Eufória, kikapcsolódás |
| 1.0 | 0.1 | Depresszió, hányinger, hányás, csökkent érzékszervi és motorikus képességek, lelassult a megismerés |
| > 1.4 | > 0,14 | Csökkent véráramlás az agyban |
| 3.0 | 0,3 | Eszméletvesztés |
| 4.0 | 0.4 | Lehetséges halál |
| 5.5 | 0,55 | Halál |
A vér alkoholszintje
A BAC az etanol mennyisége a vérben; általában grammban / liter vérben fejezik ki. A 4,0 g L- 1- t meghaladó véralkoholszint halálos kimenetelű lehet, és a szint 5,5 g L- 1 fölött halálossá válik . Alacsony, 0,5 g L- 1 alatti etanol-dózis eufória érzést vált ki , az emberek beszédesebbé, kevésbé gátoltá és csökkent analitikai képességekkel rendelkeznek. Az 1,0 g L -1 feletti nagyobb dózisoknál az etanol depresszánsként hat a központi idegrendszerre , a tünetek lassabb kognícióval , csökkent érzékszervi képességekkel és motoros funkcióval, eszméletvesztéssel járnak , halálig.
Központi idegrendszeri hatások
Az etanol a központi idegrendszer depresszánsai , és kábítószer- pszichotrópnak számít . Főleg a GABA A receptorokkal kölcsönhatásban hat a központi idegrendszerre , fokozva a γ-aminovajsav (vagy GABA) neurotranszmitter gátló hatását . A GABA lelassítja az idegsejtek aktivitását (ellentétben a glutamáttal, amely információgyorsító); így a GABA receptorokhoz kötődve az etanol eltúlozza az agy lelassulását . Ezért pozitív alloszterikus modulátorként működik . Az etanol a szerotonin , a glutamát , az acetilkolin és a dopamin receptoraira is hat . Negatív hatásait súlyosbíthatja az ólom, amely fokozza az oxidatív stresszt . Az ólom erősíti az alkohol központi idegrendszerre (CNS) gyakorolt hatását .
Az etanol hosszan tartó fogyasztása ezért maradandó károsodást okozhat az agyban és más szervekben. A megvonási alkohol különféle tüneteket okozhat, mint például figyelemzavar , fokozott izzadás, tachycardia , remegés (a végtagok remegése), néha hányinger vagy hányás, dehidráció, rossz közérzet , a magas vérnyomás . Néha epilepszia , vizuális, tapintási vagy halliucinációk rohama kíséri, delírium tremens a legsúlyosabb formájában. Végül és ritka esetekben megjelenhet az állkapocs és a koponya közötti fájdalom. Kimutatták, hogy az etanol a szabad szemmel látható szürkeállomány méretét is megváltoztatja .
Az anyagcserére gyakorolt hatások
Mint ilyen, az etanol tápanyag . Az emberi testben az alkohol-dehidrogenáz enzim metabolizálja acetaldehiddé . Acetaldehid ezt követően alakítjuk a acetaldehid-dehidrogenáz , hogy acetil-koenzim-A , amely a végtermék a szénhidrát- és lipid-metabolizmus . Maga az acetaldehid sokkal mérgezőbb, mint az etanol, és részben felelős az alkohol legtöbb klinikai hatásáért, például a másnaposságért . Különösen azt kimutatták, hogy növeli a cirrhosis a máj , és kapcsolódik a számos formája a rák .
Hosszútávú hatások
Etanol minősül teratogén hatóanyag , és indukálhat magzati alkohol szindróma , amely az alkohol mérgezés az embrió vagy a magzat miatt anyai alkoholfogyasztás során a terhesség , és amely megzavarja fejlesztési szervek.
A rendszeres alkoholfogyasztás szintén hozzájárul a trigliceridek növekedéséhez a vérben, ami kedvez a szív- és érrendszeri betegségek megjelenésének .
Az alkoholtartalmú italokban található etanolt határozottan rákkeltőnek tekintik , ezért az IARC 1. csoportjába tartozó rákkeltő anyagok egyike .
Gyógyszerkölcsönhatások
Az etanol fokozhatja a központi idegrendszerre ható kábítószer- depresszánsok , például barbiturátok , benzodiazepinek , opioidok , fenotiazinok és antidepresszánsok által okozott szedáció jelenségét .
Megjegyzések és hivatkozások
- (fr) Ez a cikk részben vagy egészben venni a Wikipedia cikket angolul című „ Etanol ” ( lásd a szerzők listáját ) .
- ETHANOL (ANHYDRO) , a Kémiai Biztonság Nemzetközi Programjának biztonsági adatlapja (i) , konzultálva 2009. május 9-én
- (in) Y. Marcus , Az oldószerek tulajdonságai , Chichester, Anglia, John Wiley & Sons , al. "Solution Chemistry" ( n o 4),1998, 254 p. ( ISBN 978-0-471-98369-9 és 0471983691 , LCCN 98018212 , online előadás ) , p. 95
- Marcus, 1998 , p. 88.
- számított molekulatömege a „ atomsúlya a Elements 2007 ” on www.chem.qmul.ac.uk .
- (a) James E. Mark, fizikai tulajdonságai: Polymer Handbook , Springer,2007, 2 nd ed. , 1076 p. ( ISBN 978-0-387-69002-5 és 0-387-69002-6 , online olvasás ) , p. 294
- (a) Serban Moldoveanu, Minta előkészítés kromatográfia , Amsterdam / Boston, Elsevier ,2002, 930 p. ( ISBN 0-444-50394-3 ) , p. 258
- " Toxikológiai lap FT 48 - Etanol " , a Munkahelyi Balesetek és Foglalkozási Betegségek Megelőzéséért Országos Kutatási és Biztonsági Intézet honlapján ,2011(megtekintés : 2012. május 14. ) .
- (in) RH Perry és DW Green , Perry vegyészmérnökök kézikönyve , McGraw-Hill ,1997, 7 -én ed. , 2640 p. ( ISBN 978-0-07-049841-9 , LCCN 96051648 ) , p. 2-50.
- (in) CA Faúndez és OJ Valderrama , " Aktivitási együttható modellek a gőz-folyadék egyensúly leírására a ternáris hidroalkoholos oldatokban " , Chin. J. Chem. Eng. , vol. 17, n o 22009. április, P. 259-267 ( ISSN 1004-9541 , DOI 10.1016 / S1004-9541 (08) 60203-7 )
- (a) William M. Haynes , CRC Handbook of Chemistry and Physics , Boca Raton, CRC Press / Taylor and Francis,1 st július 2010, 91 th ed. , 2610 p. ( ISBN 9781439820773 , online előadás ) , p. 14–40
- (in) O. Haida , H. Suga és mtsai. , „ Az üveges állapot kalorimetriai vizsgálata XII. Az etanol többszörös üvegesedési jelenségei ” , J. Chem. Termodinamika. , vol. 9, n o 12,1977. december, P. 1133–1148 ( ISSN 0021-9614 , DOI 10.1016 / 0021-9614 (77) 90115-X ).
- (a) J. Chao és FD Rossini , " égéshőjének, képzés, és izomerizációja alkanolok tizenkilenc " , J. Chem. Eng. Data , vol. 10, n o 4,1965, P. 374–379 ( ISSN 0021-9568 , DOI 10.1021 / je60027a022 ).
- (a) Carl L. yaws, Handbook of termodinamikai diagramok: Szerves vegyületek C8 C28 , vol. 1, Huston, Texas, Gulf Pub. Co.,1996, 396 p. ( ISBN 978-0-88415-857-8 , LCCN 96036328 )
- (in) David R. LiDE , CRC Handbook of Chemistry and Physics , Boca Raton, CRC Press,2002. június 18, 83 th ed. , 2664 p. ( ISBN 0849304830 , online előadás ) , p. 5-89
- (in) David R. LiDE , CRC Handbook of Chemistry and Physics , Boca Raton, CRC Press / Taylor and Francis,2008. június 17, 89 th ed. , 2736 p. ( ISBN 9781420066791 , online előadás ) , p. 10-205
- " Ethanol " , a reciprocalnet.org címen (hozzáférés : 2009. december 12. )
- [1]
- IARC munkacsoportja az embert érintő rákkeltő kockázatok értékelésével , „ Az emberi rákkeltő hatás globális értékelése, 1. csoport: Emberi rákkeltő ” , http://monographs.iarc.fr , IARC,2009. január 16(megtekintés : 2009. augusztus 22. )
- Biztonsági adatlapot a Sigma-Aldrich bocsátotta rendelkezésre, konzultálva: 2019.09.28
- " Etil-alkohol " , a hazmap.nlm.nih.gov címen (hozzáférés : 2009. november 14. )
- " ESIS " (hozzáférés : 2008. december 6. )
- (in) GP Moss ( szerk. ), " A sztereokémia alapvető terminológiája " , Pure Appl. Chem. , IUPAC , vol. 68, n o 12,1996, P. 2193-2222 ( ISSN 0033-4545 és 1365-3075 , DOI 10.1351 / pac199668122193 ).
- (en) PE McGovern , J. Zhang et al. , „A történelem előtti és a történelem előtti Kína erjesztett italai ” , Proc. Natl. Acad. Sci. USA , vol. 101, n o 51,2004. december 21, P. 17593-17598 ( ISSN 0027-8424 , PMID 15.590.771 , PMCID PMC539767 , DOI 10,1073 / pnas.0407921102 , olvasható online ).
- (en) RJ Forbes , A lepárlás művészetének rövid története: a kezdetektől a halálig Cellier Blumenthal , Leiden, Hollandia, Brill ,1970, 2 nd ed. ( 1 st ed. 1948), 405 p. ( ISBN 978-90-04-00617-1 , online előadás , online olvasás ) , p. 89.
- " Mohammad Ibn Zakariâ Râzi (865-925), az iszlám civilizáció legkiválóbb orvosa - La Revue de Téhéran | Irán ” , www.teheran.ir (hozzáférés : 2016. július 9. )
- (in) " Alkohol " , az Encyclopaedia Britannica oldalán ,1911(megtekintés : 2012. május 12. ) .
- (in) AS Cut , " új kémiai elmélet volt " , Philos. Mag. , 4 -én -sorozat, vol. 16,1858, P. 104–116 ( ISSN 1478-6435 , online olvasás ).
- (in) H. Hennell , " A kénsav és az alkohol kölcsönös hatásáról , megjegyzésekkel az eredményül kapott vegyület összetételére és tulajdonságaira " , Philos. Ford. R. Soc. , vol. 116,1826. március 9-én, P. 240–249 ( DOI 10.1098 / rstl.1826.0021 , online olvasás ).
- (in) Joseph DiPardo, " A biomassza-etanol termelésének és keresletének kilátásai " , az energiainformációs igazgatásról (hozzáférés: 2012. május 14. )
- (in) VD vadászat , a gasohol kézikönyv , New York Ipari Press,tizenkilenc nyolcvan egy, 580 p. ( ISBN 978-0-8311-1137-3 , online előadás ).
- (in) R. Dudley , " Az etanolos gyümölcs érése és az emberi prímás alkoholizmus történelmi eredete a takarékosságban " , Integr . Comp. Biol. , vol. 44, n o 4,2004, P. 315-323 ( ISSN 1540-7063 , DOI 10.1093 / icb / 44.4.315 ).
- Kreuzwieser J, Papadopoulou E & Rennenberg H (2004) Az fl várakozás kölcsönhatása az erdei fák szén-anyagcseréjével , Plant Biol., 6, 299–306, 2004
- Kimmerer TW és MacDonald RC (1987) Acetaldehid és etanol bioszintézise növényi levelekben , Plant Physiol., 84, 1204–1209
- (in) S. Leblová E. Sineckáet et al. , „ Piruvát anyagcsere a csírázó magokban a természetes anaerobiosis során ” , Biol. Plantarum , vol. 16, n o 6,1974, P. 406-411 ( ISSN 0006-3134 , DOI 10.1007 / BF02922229 ).
- Kirstine WV és Galbally IE (2011) A globális légköri költségvetés etanolát áttekintették ; Légköri kémia és fizika 11 (1): 25909-25936 | Szeptember | DOI: 10.5194 / acpd-11-25909-2011
- (in) A. Schriver , L. Schriver-Mazzuoli et al. , „ Az etanol egyik lehetséges eredete csillagközi közegben: A vegyes CO 2 –C 2 H 6 filmek fotokémiája 11 K-nál. A FTIR-tanulmány ” , Chem. Phys. , vol. 334, n csont 1-3,2007, P. 128–137 ( DOI 10.1016 / j.chemphys.2007.02.018 ).
- (en) M. Windholz ( szerk. ), The Merck Index: An Encyclopedia of Chemicals and Drugs , vol. 9, Merck ,1976, 9 -én ed. , 1835 p. ( ISBN 978-0-911910-26-1 ).
- (en) U. Dahlmann és GM Schneider , " (folyadék + folyadék) egyensúlyi fázis és kritikus görbék (etanol + dodekán vagy hexadekán tetradekán arany vagy 2,2,4,4,6,8,8-heptametilnonán) 0, 1 MPa - 120,0 MPa ” , J. Chem. Termodinamika. , vol. 21, n o 9,1989. szeptember, P. 997–1004 ( ISSN 0021-9614 , DOI 10.1016 / 0021-9614 (89) 90160–2 ).
- (a) C. Reichardt és T. Welton , oldószerek és oldószer hatások a szerves kémiában , Weinheim, Wiley-VCH ,2010, 4 th ed. , 692 p. ( ISBN 978-3-527-32473-6 , DOI 10.1002 / 9783527632220 , online előadás ) , „Függelék” , p. 568.
- (en) JE Logsdon , Kirk-Othmer kémiai technológiai enciklopédia , John Wiley & Sons ,2004( ISBN 978-0-471-23896-6 , DOI 10.1002 / 0471238961.0520080112150719.a01.pub2 , online olvasás ) , "Etanol".
- (en) MJ Costigan , LJ Hodges és munkatársai. , „ Az izotermikus elmozdulásos kaloriméter: Tervezési módosítások a keverés exoterm entalpiainak mérésére ” , Aust. J. Chem. , vol. 33, n o 10,1980, P. 2103-2119 ( ISSN 0004-9425 , DOI 10.1071 / CH9802103 ).
- (a) RW Rousseau , Handbook of Separation Process Technology , John Wiley & Sons ,1987, 1010 p. ( ISBN 978-0-471-89558-9 , online olvasás ) , p. 261–262.
- J. Vidal , Termodinamika: alkalmazás a vegyiparban és a kőolajiparban , Párizs, Éditions Technip ,1997, 500 p. ( ISBN 978-2-7108-0715-5 , LCCN 97194455 , online olvasás ) , p. 181.
- (in) J. Thomson , " a bor és más alkoholos folyadékok felszínén megfigyelhető néhány furcsa mozgás " , Philos. Mag. , vol. 10,1855, P. 330-333 ( online olvasás ).
- (en) GA Mills és EE Ecklund , " Alkoholok, mint összetevői üzemanyagok " , Annu. Fordulat. Energia kb. , vol. 12,1987. november, P. 47–80 ( DOI 10.1146 / annurev.eg.12.110187.000403 ).
- (en) PB Morais , CA Rosa és munkatársai. , „ Üzemanyag-alkohol termelése Saccharomyces törzsek által trópusi élőhelyekről ” , Biotechnol. Lett , vol. 18, n o 11,1996, P. 1351-1356 ( ISSN 0141-5492 , DOI 10.1007 / BF00129969 ).
- (in) PC Badger , J. Janick ( szerk. ) És A. Whipkey ( szerk. ), Trends in új termények és az új felhasználások , Alexandria, VA, ASHS Press,2002, 599 p. ( ISBN 978-0-09-707565-5 , online olvasás ) , „Cellulózból származó etanol: általános áttekintés” , p. 17–21.
- (in) MJ Taherzadeh és K. Karimi , " Savalapú hidrolízis folyamatok etanolhoz lignocellulózos anyagokból: áttekintés " , BioRes. , vol. 2. n o 3.,2007, P. 472-499 ( ISSN 1930-2126 , online olvasás ).
- (in) MJ Taherzadeh és K. Karimi , " Enzim alapú hidrolízis folyamatok etanolhoz lignocellulózos anyagokból: áttekintés " , BioRes. , vol. 2, n o 4,2007, P. 707-738 ( ISSN 1930-2126 , online olvasás ).
- (in) SK Ritter , " Biomassza-aranyrobbantás: A növényi eredetű cukrok kémiai alapanyagok előállítására való felhasználásának technológiája készen áll és vár ... " , Chem. Eng. News , vol. 82, n o 22,2004. május, P. 31–34 ( ISSN 0009-2347 , online olvasás ).
- (in) " Brew Better Ethanol " a Popular Science Online-on ,2006(megtekintés : 2012. május 18. ) .
- (a) DR LiDE ( szerk. ), CRC Handbook of Chemistry and Physics , Boca Raton, FL, CRC Press ,2007, 88 th ed. , 2640 p. ( ISBN 978-0-8493-0488-0 ) , fejezet. 8. ("Analitikai kémia") , p. 42.
- (in) HD Hinton és JA Nieuwland , " Szerves reakciók bór-fluoriddal. I. Az észterek előállítása ” , J. Am. Chem. Soc. , vol. 54, n o 5,1932, P. 2017–2018 ( ISSN 0002-7863 , DOI 10.1021 / ja01344a046 ).
- (in) " Rulemaking History for OTC Sweet Spirits of Nitre Drug Products " az Élelmiszer- és Gyógyszerügyi Hatóságon (hozzáférés: 2012. május 22. ) .
- (a) K. Schumann és K. Siekmann , Ullmann s Encyclopedia of Industrial Chemistry , Wiley-VCH Verlag ,2000( ISBN 978-3-527-30673-2 , online előadás ) , "Szappanok".
- Lide, 2007 , fejezet. 5. ("Termokémia, elektrokémia és kinetika"), p. 70.
- Lide, 2007 , fejezet. 15. („Gyakorlati laboratóriumi adatok”), p. 17 .
- (in) R. Swift és D. Davidson , " Alkohol másnaposság: Mechanizmusok és közvetítők " , Alcohol Health Res. W. , vol. 22, n o 1,1998, P. 54–60 ( online olvasás ).
- (in) L. Hipolito , J. Sanchez és mtsai. , „ Az etanol agyi anyagcseréje és az alkoholizmus: frissítés ” , Curr. Drug Metab , vol. 8, n o 7,2007. október, P. 716-727 ( ISSN 1389-2002 , PMID 17979660 , DOI 10.2174 / 138920007782109797 ).
- (pdf) 120. számú toxikológiai lap az INRS-től, konzultálva 2017. június 24-én
- Juan I. Garaycoechea és mtsai. (2018) Az alkohol és az endogén aldehidek károsíthatja kromoszómák és mutáció őssejtek | Természet | doi: 10.1038 / nature25154 | online közzétéve 2018. január 3-án | absztrakt
- (a) L. Kürti és B. Czako , stratégiai alkalmazásai Nevezett Reactions in Organic Synthesis , Academic Press ,2005, 864 p. ( ISBN 978-0-12-369483-6 , online előadás ) , p. 264-265.
- GS Serullas , „ Szénhidriodid . Különleges körülmények, amelyekben ez a hármas kombináció történt; az azonnali előállítás eszköze ”, Annal. Chim. Phys. , vol. 20,1822 május, P. 17–37 ( online olvasás ).
- " A szuperetanol legújabb változása E85..N645843 " , az usinenouvelle.com oldalon .
- (a) G. McDonnell és AD Russell , " antiszeptikus szerek és fertőtlenítők: Activity, Action, és ellenállás " , Clin. Microbiol. Fordulat. , vol. 12, n o 1,1999, P. 147–179 ( ISSN 0893-8512 , PMCID PMC88911 , online olvasás [PDF] ).
- (en) DG Barceloux , GR Bond és munkatársai. , „ Amerikai Klinikai Toxikológiai Akadémia Gyakorlati útmutató a metanolmérgezés kezelésére ” , Clin. Toxicol. , vol. 40, n o 4,2002, P. 415-446 ( DOI 10.1081 / CLT-120006745 ).
- (in) YB Shvets , Washington állomás: My Life as a KGB kém Amerikában , New York, Simon & Schuster ,1995, 298 p. ( ISBN 978-0-671-88397-3 ).
- (in) " V2 " on Rocket and Space Technology (hozzáférés: 2012. május 27. ) .
- (in) " Rocket Propellants " , a The Internet Encyclopedia of Science (hozzáférés: 2012. május 27. ) .
- (in) " A rakéta rövid története " a Kennedy Űrközpontban (hozzáférés: 2012. május 27. ) .
- (in) LA Pohorecky és J. Brick , " Ethanol farmakológiája " , Pharmacol. Ther. , vol. 36, n csont 2-31988, P. 335–427 ( ISSN 0163-7258 , PMID 3279433 , DOI 10.1016 / 0163-7258 (88) 90109-X ).
- (in) " Ethanolum anhydricum " az Európai Gyógyszerminőségi Igazgatóságról (hozzáférés: 2012. május 28. ) .
- (a) DJ Nutt , AZ király és mtsai. , „A kábítószer-ártalom az Egyesült Királyságban: több kritériumot tartalmazó elemzés ” , Lancet , vol. 376, n o 9752,2010. november 6, P. 1558-1565 ( ISSN 0140-6736 , DOI 10.1016 / S0140-6736 (10) 61462-6 ).
- (en) DA Yost : „ Az alkoholos mérgezés akut gondozása. Legyen kész figyelembe venni a klinikai dilemmákat ” , Postgrad Med. , vol. 112, n o 6,2002, P. 14–26 ( ISSN 0032-5481 , PMID 12510444 , DOI 10.3810 / pgm 2002.12.1361. ).
- (a) V. Santhakumar , Mr. Wallner et al. , „ Az etanol a tonikus gátlás fokozása érdekében közvetlenül hat a GABA A receptorok extraszinaptikus altípusaira ” , Alcohol , vol. 41, n o 3,2007. május, P. 211-221 ( ISSN 0741-8329 , PMID 17.591.544 , PMCID PMC2040048 , DOI 10.1016 / j.alcohol.2007.04.011 , olvasható online ).
- Virgolini, MB, Mattalloni, MS, Deza-Ponzio, R., Albrecht, PA és Cancela, LM (2019). Ólom expozíció és etanol bevitel: Oxidatív stressz, mint konvergáló hatásmechanizmus . In Neuroscience of Alcohol (515-525. O.). Academic Press ( absztrakt ).
- (en) Fein G, D Greenstein, Cardenas VA, Cuzen NL, Stein DJ és munkatársai. , „ Az agykérgi és kéreg alatti mennyiségek serdülőknél alkoholfüggők, de anélkül, hogy az anyag vagy pszichiátriai társbetegségek ” , Psychiatry Res , vol. 214, n o 1,2013, P. 1-8. ( PMID 23916536 , PMCID PMC4203651 , DOI 10.1016 / j.pscychresns.2013.06.001 , online olvasás [html] )
- (in) Little G, P Maurage, Kornreich C Verbanck P, S Campanella, " Fogyasztás serdülőknél: áttekintés a neurofiziológiai és a neuro-képalkotó kutatásról " , Alcohol Alcohol , vol. 49, n o 22014, P. 198-206. ( PMID 24302160 , DOI 10.1093 / alcalc / agt172 , online olvasás [html] )
- (en) K. Nakamura , K. Iwahashi et al. , „ Acetaldehid-adduktok az alkoholisták agyában ” , Arch. Toxicol. , vol. 77, n o 10,2003, P. 591-593 ( ISSN 0340-5761 , DOI 10.1007 / s00204-003-0465-8 ).
Lásd is
Bibliográfia
- (en) JE Logsdon , Kirk-Othmer kémiai technológiai enciklopédia , John Wiley & Sons ,2004( ISBN 978-0-471-23896-6 , DOI 10.1002 / 0471238961.0520080112150719.a01.pub2 , online olvasás ) , "Etanol".
- (en) LA Pohorecky és J. Brick , „ Farmakológia etanol ” , Pharmacol. Ther. , vol. 36, n csont 2-31988, P. 335–427 ( ISSN 0163-7258 , PMID 3279433 , DOI 10.1016 / 0163-7258 (88) 90109-X ).
Kapcsolódó cikkek
- Egyéb alkoholok: alkohol , primer alkohol , metanol , propanol és butanol
- Tulajdonságok: Abszolút alkohol , Metilezett szesz , denaturált alkohol és rektifikált alkohol
- Előállítás: Alkoholos fermentáció , Cellulóz-etanol
- Használat: alkohol , bioetanol , alkoholos ital , szeszes ital , alkoholipar
- Történelem: A sör , a szőlő és a bor története
- Fiziológiai tulajdonságok: Alkohol-dehidrogenáz , Alkoholémia , Alkoholizmus , Másnaposság , Alkohol-mérgezés , Magzati alkohol-szindróma
- Egyéb: számítása alkohol címek és kötetek , alkohol szintje , Tears bor , Szeszes kivonatolás










