Hidrogén cianid
| Hidrogén cianid | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Azonosítás | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| IUPAC név | hidrogén cianid | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Szinonimák |
Ciano- |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o CAS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o ECHA | 100 000 747 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o EC | 200-821-6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mosolyok |
C ([H]) # N , |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| InChI |
InChI: InChI = 1 / CHN / c1-2 / h1H |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Megjelenés | színtelen folyadék vagy gáz jellegzetes szaggal | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kémiai tulajdonságok | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Brute formula | HCN | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Moláris tömeg | 27,0253 ± 0,0011 g / mol C 44,44%, H 3,73%, N 51,83%, |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| pKa | 9,2 - 9,3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dipoláris pillanat | 2,985188 D | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fizikai tulajdonságok | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T ° fúzió | -13 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T ° forráspontú | 26 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oldékonyság | vízben: keverhető,
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oldhatósági paraméter δ | 24,8 MPa 1/2 ( 25 ° C ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Térfogat |
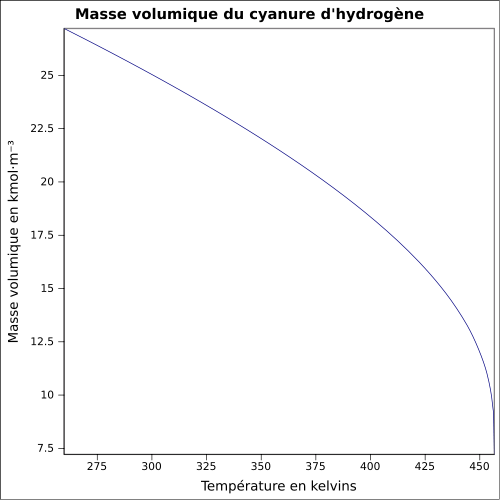
0,69 g cm −3 (folyadék)
egyenlet:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Öngyulladási hőmérséklet | 538 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Lobbanáspont | −18 ° C (zárt pohár) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Robbanási határok a levegőben | 5,6 - 40,0 térfogat% | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
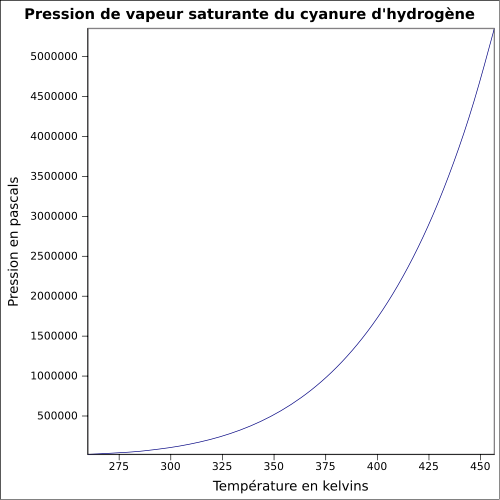
| Telített gőznyomás | át 20 ° C-on : 82,6 kPa
egyenlet:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dinamikus viszkozitás | 0,192 mPa · s ( 20 ° C ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kritikus pont | 53,9 bar , 183,55 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Termokémia | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| S 0 folyadék, 1 bar | 109 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Δ f H 0 folyadék | 113,01 J / mol K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| C o | 71,09 J mol -1 K -1 ( 20 ° C , folyékony) 35,85 J · mol -1 · K -1 ( 25 ° C , gáz) egyenlet:
egyenlet:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PCS | 671,5 kJ · mol -1 ( 25 ° C , gáz) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronikus tulajdonságok | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1 re ionizációs energia | 13,60 ± 0,01 eV (gáz) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Óvintézkedések | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SGH | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
   Veszély H224, H330, H410, H224 : Fokozottan tűzveszélyes folyadék és gőz H330 : Belélegezve halálos H410 : Nagyon mérgező a vízi élővilágra, hosszan tartó károsodást okoz   Veszély H300, H310, H330, H410, H300 : Lenyelve halálos H310 : Bőrrel érintkezve halálos H330 : Belélegezve halálos H410 : Nagyon mérgező a vízi élővilágra, hosszan tartó károsodást okoz |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| WHMIS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
   B2, D1A, F, B2 : gyúlékony folyadék flash- pont = -18 ° C zárt téri (módszer nem jelentett) D1A : Nagyon mérgező anyag, amelynek súlyos azonnali hatása veszélyes anyagok szállítása: Osztály 6.1 I csoport F : veszélyesen reaktív anyag alá egy heves reakció polimerizációs 1,0% közzététel az összetevők közzétételi listája szerint |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NFPA 704 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4 4 1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Szállítás | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
1051 : HIDROGÉN-CIANID, STABILIZÁLT, 3% -nál kevesebb vízzel osztály: 6.1 Osztályozási kód: TF1 : Gyúlékony mérgező anyagok: Folyadékok; Címkék: 6.1 : Mérgező anyagok 3 : Gyúlékony folyadékok Csomagolás: I. csomagolási csoport : nagyon veszélyes anyagok;  
663 : nagyon mérgező és tűzveszélyes anyag (lobbanáspontja legfeljebb 60 ° C ) ENSZ-szám : 1613 : HIDRO-CIANSAV VÍZ MEGOLDÁSBAN, legfeljebb 20% hidrogén-cianidot tartalmaz; vagy legfeljebb 20% hidrogén-cianidot tartalmazó HIDROGEN-CIANID-VÍZMEGOLDÁS Osztály: 6.1 Osztályozási kód: TF1 : Gyúlékony mérgező anyagok: Folyadékok; Címkék: 6.1 : Mérgező anyagok 3 : Gyúlékony folyadékok Csomagolás: I. csomagolási csoport : nagyon veszélyes anyagok;  
1614 : HIDROGÉN-CIANID, STABILIZÁLVA, kevesebb mint 3% vízzel és inert porózus anyagban felszívódva Osztály: 6.1 Osztályozási kód: TF1 : Gyúlékony mérgező anyagok: Folyadékok; Címkék: 6.1 : Mérgező anyagok 3 : Gyúlékony folyadékok Csomagolás: I. csomagolási csoport : nagyon veszélyes anyagok;  
663 : nagyon mérgező és gyúlékony anyag (lobbanáspontja legfeljebb 60 ° C ) ENSZ-szám : 3294 : HIDROGÉN-CIANID, ALKOHOLOS MEGOLDÁS, legfeljebb 45% hidrogén-cianidot tartalmaz. Osztály: 6.1 Kód Osztályozás: TF1 : Gyúlékony mérgező anyagok: Folyadékok; Címkék: 6.1 : Mérgező anyagok 3 : Gyúlékony folyadékok Csomagolás: I. csomagolási csoport : nagyon veszélyes anyagok;   |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Belélegzés | Nagyon mérgező | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bőr | Nagyon mérgező | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Szemek | Kötőhártya-gyulladást okoz | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Lenyelés | Nagyon mérgező | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ökotoxikológia | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LogP | −0,25 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Szagküszöb | alacsony: 2 ppm magas: 10 ppm |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Egység SI és STP hiányában. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
A hidrogén-cianid egy kémiai vegyület , amelynek képlete HC≡N. Egy vizes oldat a cianid a hidrogén nevezzük hidrociánsav (vagy kéksav ).
Rendkívül mérgező termék, és halálos kimenetelű lehet, mert anoxiát okoz . A természetben gyakran benzaldehiddel társul, amely jellegzetes keserű mandula szagot áraszt , amelyre néhány ember nem érzékeny.
Történelem
A hidrogén-cianidot eredetileg egy kék pigmentből ( porosz kék ) izolálták , amely 1704 óta ismert, de amelynek szerkezete ismeretlen volt. Ma már tudjuk, hogy ez egy koordinációs polimer, bonyolult felépítésű és a hidratált vas-ferrocianid empirikus képlete.
1752-ben Pierre Macquer francia vegyész megmutatta, hogy a porosz kék átalakulhat vas-oxiddá és illékony vegyületté, és hogy e két termék kombinációja visszaadta a porosz kéket. Az új vegyület pontosan hidrogén-cianid volt. Miután Macquer, a svéd kémikus Carl Wilhelm Scheele szintetizált hidrogén-cianid 1782-ben, és nevezte el Blausäure ( világít „Acid kék”), miután felismerte a savasság. Angolul jobban ismert, mint porzsav.
1787-ben Claude Louis Berthollet francia vegyész kimutatta, hogy a hidrogén-cianid nem tartalmaz oxigént, ami elengedhetetlen a savak elméletéhez , Lavoisier azt feltételezte, hogy minden sav tartalmaz oxigént (az oxigén neve a görögből származik, ami azt jelenti, hogy "ami savasságot generál"). ", mint a német Sauerstoff esetében ). 1811-ben Joseph Louis Gay-Lussac-nak sikerült a tiszta hidrogén-cianid cseppfolyósítása, majd 1815-ben megalkotta kémiai képletét.
Természetes források
Rendkívül mérgező hidrogén-cianidot bizonyos növények termelnek természetesen, és megtalálható különösen a keserűmandulában, az őszibarackban (és általában a Prunus nemzetség gyümölcsének köveiben ), a medlárokban , a cseresznye levelében ( Prunus avium ) és a cseresznye babérjában ( Prunus laurocerasus ), cirok (a fiatal növény éretlen magvakat), Hieble bodza és manióka . Részt vesz a cseresznye (például a benzaldehid) aromájában is.
Cianohidrinekben , például mandelonitrilekben van jelen , és kémiailag kivonható belőlük . Néhány ezerlábú védőmechanizmusként a hidrogén-cianidot adja le. Ez tartalmazza a kipufogógázok belső égésű járművek, a dohány füst és az égési füst bizonyos nitrogén - tartalmú műanyagok - jellegzetesen, poliakrilnitril és rokon kopolimerek, ABS és SAN , hanem poliuretán .
Előkészítés és szintézis
A hidrogén-cianidot nagy mennyiségben állítják elő két eljárással:
- a Degussa folyamatban , a ammóniát és a metán reagál 1200 ° C felett katalizátor a platina .
- az Andrussow-folyamatban dioxigént adnak hozzá:
- A Shawinigan-eljárás meglehetősen hasonlít az előzőekhez, de fő alkotórészként szénhidrogén-részecskéket használ propánnal:
- A laboratóriumban kis mennyiségű HCN keletkezik a sav lúgos cianidra gyakorolt hatásával.
Ez a reakció a véletlen mérgezések forrása.
Tulajdonságok
Fizikai tulajdonságok
A hidrogén-cianid tiszta állapotában színtelen, nagyon illékony folyadékként, vagy színtelen gázként fordul elő, amely jellegzetes keserű mandula szagot áraszt. 26 ° C-on forr .
Minden arányban elegyedik vízzel és etanollal , oldható dietil- éterben ( éter ).
A levegőben levő hidrogén-cianid gáz 56 000 ppm (5,6%) koncentrációtól robbanásveszélyes .
Kémiai tulajdonságok
A tiszta hidrogén-cianid stabil.
Kevésbé tiszta, mivel forgalmazzák, és ha nem stabilizálódik, polimerizálva barna lerakódást eredményez. Ez az exoterm és autokatalitikus folyamat víz és lúgos reakciótermékek jelenlétében felgyorsul, és így robbanásszerű reakcióhoz vezethet. A leggyakoribb stabilizátor foszforsav, arányban alkalmazzuk a 50 , hogy 100 ppm .
A hidrogén-cianid gyengén savas és gyárt CN cianid-ionokat - vizes oldatban. A hidrociánsav sóit cianidoknak nevezzük.
Reakciók
HCN + R-CO-R '( keton vagy aldehid ) → RC (OH) (CN) -R' ( cianohidrin )A hidrogén-cianid ég a levegőben, víz , szén-dioxid és nitrogén keletkezve .
Prebiotikus kémia
A hidrociánsav állítólag a légkörben jelenlévő molekuláris nitrogén disszociációja révén keletkezett. Az ultraibolya sugarak képesek végrehajtani ezt a reakciót, feltéve, hogy kellően energikusak (hullámhosszuk kevesebb, mint 100 nm ), ami kizár minden olyan reakciót a légkör legalacsonyabb rétegeiben, ahol a legenergiásabb ultraibolya sugarak elnyelődnek. Úgy tűnik, hogy a hidrogén-cianidsav nitrogénből történő szintézisének előnyös módja a villámlás, amely jelentős energiát szabadít fel az útjukon, amely képes sok molekula megtörésére. Miután a dinitrogén molekula megszakadt, egy nitrogénatom reakcióba léphet egy metán (CH 4 ) molekulával , így hidrogén-cianinsavat és hidrogént kap.
A diaminomaleonitril (en) tetramer hidrogén-cianid polimerizációjával képződik. Fotokémiai reakcióval 4-amino-imidazol-5-karbonitrillé alakul át, amely ezután számos heterociklus szintézisét teszi lehetővé . Ezért lehetséges prebiotikus kémia eredetű vegyületjelöltnek tekintik.
Használ
A hidrogén-cianidot a következők előállítására használják:
- a fertőtlenítést végző , a peszticidek ;
- a nitrilek és gyanták monomerek (a akrilnitril , különösen, előállításához használt akril szálak, műanyagok);
- ez a Zyklon B fő eleme , amelyet a náci megsemmisítő táborok gázkamráiban használnak .
Biztonság
Lásd az EK irányelvek szerinti címkézés részt a cikk végén.
Tűzveszély
A hidrogén-cianid, amelynek lobbanáspontja a -17,8 ° C (zárt téri), rendkívül tűzveszélyes. Robbanékony keverékeket képezhet a levegővel, robbanási határértékei 5,6 és 41 térfogatszázalék.
Nyilvános létesítmények (ERP)
Franciaországban a módosított 1975. november 4-i rendelet előírja, hogy a belső berendezésekben használt gyúlékony anyagok tömege ne eredményezzen olyan nitrogénmennyiséget, amely hidrogén-cianid formájában több mint öt gramm / térfogat köbméter. a figyelembe vett helyi.
Toxicitás emberre
Akut mérgezés történhet lenyeléssel , belélegzéssel vagy a bőrrel való érintkezéssel. A levegőben 300 ppm koncentráció perceken belül megöli az embert. Toxicitását a cianidion okozza. A hidrogén-cianidot az Egyesült Államokban a halálbüntetés végrehajtásának módszereként alkalmazzák, és a náci rezsim ( Zyklon B néven ) megsemmisítő táborokban használta a "halál megsemmisítésének" eszközeként. Ugyanazt a terméket a mai napig gyártják Csehországban, „ Uragan D2 ” néven, és rovarirtóként használják.
A szaglásérzékelési küszöb figyelmes, egészséges és megszokatlan személyeknél kevesebb, mint 1 ppm ; genetikai okokból azonban sok embernek alig vagy egyáltalán nincs érzéke a hidrogén-cianid szagához.
A fél óránál hosszabb ideig belélegzett 50 ppm feletti levegőben lévő koncentrációk jelentős kockázatot jelentenek, míg a 200–400 ppm vagy annál magasabb szintet néhány perces expozíció után végzetesnek tekintik. Mint egy útmutató, a halálos adag patkány 484 ppm egy öt perces expozíció.
Forrás
- Institut National de Recherche et de sécurité, hidrogén-cianidot és vizes oldatok [PDF] , SDB n o 4 1997 Paris, 5 p.
Az alomban
- Az Embargo (1976) című cikkben Gérard de Villiers szerző azt képzeli, hogy a terroristák hidrogén-cianid segítségével ölik meg áldozataikat.
- A James Bond 007 Skyfall című filmben jelenik meg, mint motívuma annak, hogy Tiago Rodriguez (a film ellensége) bosszút álljon Mr.
- A Thérèse Raquin- ben Thérèse és Laurent a cianhidrogénnel öngyilkosságot követ el.
- Oscar Wilde Dorian Gray portréjában jelenik meg , gyaníthatóan a méreg okozta halálát Sybil Vane-nek.
A moziban
- A vizes oldatot a hidrogén-cianid alatt jelenik meg a neve kéksav során közötti párbeszéd Bernard Blier és Annie Girardot a filmben Elle oka plusz ... elle flingue (1972) által Michel Audiard idéző, egy korábbi vacsora a szemtől szemben a két karakterek és amelyek rosszul végződtek.
- Laurent és Thérèse Raquin szerelmeseinek a Titokban (2013) című filmjében porzsav néven használták életük befejezéséhez.
- Használt a Jurassic World: Fallen Kingdom film a Lokwood Mansionben.
- Használt a "Skyfall" filmben, amelyet 2012-ben adtak ki M és az MI6-os Da Silva volt ügynök párbeszéde során.
Megjegyzések és hivatkozások
- HIDROGÉN-CIANID, FOLYTATOTT, a Kémiai Biztonság Nemzetközi Programjának biztonsági adatlapja (i) , konzultálva 2009. május 9-én
- (in) David R. LiDE, Handbook of Chemistry and Physics , Boca Raton, CRC,2008. június 16, 89 th ed. , 2736 p. ( ISBN 978-1-4200-6679-1 és 1-4200-6679-X ) , p. 9-50
- számított molekulatömege a „ atomsúlya a Elements 2007 ” on www.chem.qmul.ac.uk .
- (a) James E. Mark, fizikai tulajdonságai: Polymer Handbook , Springer,2007, 2 nd ed. , 1076 p. ( ISBN 978-0-387-69002-5 és 0-387-69002-6 , online olvasás ) , p. 294
- (en) Robert H. Perry és Donald W. Green , Perry vegyészmérnökök kézikönyve , Egyesült Államok, McGraw-Hill,1997, 7 -én ed. , 2400 p. ( ISBN 0-07-049841-5 ) , p. 2-50
- " Különböző gázok tulajdonságai ", a flexwareinc.com címen (hozzáférés : 2010. április 12. )
- (a) Carl L. yaws, Handbook of Termodinamikai diagramok , Vol. 1., 2. és 3., Huston, Texas, Gulf Pub. Co.,1996( ISBN 0-88415-857-8 , 0-88415-858-6 és 0-88415-859-4 )
- (in) David R. LiDE , CRC Handbook of Chemistry and Physics , Boca Raton, CRC Press,2002. június 18, 83 th ed. , 2664 p. ( ISBN 0849304830 , online előadás ) , p. 5-89
- (in) David R. LiDE, Handbook of Chemistry and Physics , Boca Raton, CRC,2008, 89 th ed. , 2736 p. ( ISBN 978-1-4200-6679-1 ) , p. 10-205
- Indexszám 3.1 táblázatában függelék VI EK rendelet 1272/2008 (december 16, 2008)
- Indexszám: az 1272/2008 / EK rendelet (2008. december 16.) VI. Függelékének 3.1. Táblázatában
- " Hidrogén-cianid " a vegyi termékek adatbázisában Reptox of the CSST (quebeci munkavédelemért felelős szervezet), hozzáférés: 2009. április 25.
- " Hidrogén-cianid " a hazmap.nlm.nih.gov címen (hozzáférés : 2009. november 14. )
- Tom Maimone, a Prebiotikus Vegyészet .
- Cleaves, HJ, Prebiotikus kémia: Amit tudunk, amit nem , Evo. Edu. Outreach , 2012, 5, 342.
Lásd is
Kapcsolódó cikkek
Külső linkek
- Toxikológiai lap [PDF] , INRS
- Nemzetközi biztonsági adatlap
- Lap [PDF] , INERIS