Nitrogén-monoxid
| Nitrogén-monoxid | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
  Nitrogén-oxid molekula |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Azonosítás | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| IUPAC név | Nitrogén-monoxid | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o CAS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o ECHA | 100,030,233 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o EC | 233-271-0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ATC kód | R07 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PubChem | 145068 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mosolyok |
N = O , |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| InChI |
InChI: InChI = 1 / HNO / c1-2 / h1H |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Megjelenés | színtelen sűrített gáz. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kémiai tulajdonságok | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Brute formula |
N O [izomerek] |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Moláris tömeg | 30,0061 ± 0,0005 g / mol N 46,68%, O 53,32%, |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dipoláris pillanat | 0,15872 D | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fizikai tulajdonságok | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T ° fúzió | -163,6 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T ° forráspontú | -151,8 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oldékonyság | 0 ° C-os vízben : 7,4 ml / 100 ml | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Térfogat |
1,3 kg · l -1 (folyékony)
egyenlet:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Telített gőznyomás |
egyenlet:

|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kritikus pont | 65,8 bar , -93,35 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Hangsebesség | 325 m · s -1 ( 10 ° C , 1 atm ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Termokémia | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| S 0 gáz, 1 bar | 211 J / Mol K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Δ f H 0 gáz | 90,29 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Δ f H 0 folyadék | 87,7 kJ / Mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Δ vap H ° | 13,83 kJ · mol -1 ( 1 atm , -151,74 ° C ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| C o |
egyenlet:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronikus tulajdonságok | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1 re ionizációs energia | 9,26438 ± 0,00005 eV (gáz) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Óvintézkedések | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| WHMIS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
    A, C, D1A, E, A : Sűrített gáz kritikus hőmérséklete = −93 ° C C : Az oxidáló anyag oxigén felszabadításával más anyag égését okozza vagy elősegíti D1A : Nagyon mérgező anyag, súlyos azonnali hatással Veszélyes áruk szállítása: 2.3 E osztály : Maró anyagok Veszélyes áruk szállítása : 8. osztály Közzététel 1,0% -nál az összetevők közzétételi listája szerint |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 67/548 / EGK irányelv | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 T +  VS  O Szimbólumok : T + : Nagyon mérgező C : Maró O : Oxidáló R-mondatok : R8 : Éghető anyaggal érintkezve tüzet okozhat . R26 : Belélegezve nagyon mérgező. R34 : Égési sérülést okoz. S-mondatok : S9 : A tartályt jól szellőző helyen kell tartani. S17 : Éghető anyagtól távol tartandó. S26 : Ha szembe jut, bő vízzel azonnal ki kell mosni és konzultálni kell a szakemberrel. S28 : A bőrrel való érintkezés után azonnal és bőségesen mosson… (megfelelő termékeket a gyártó jelzi). S45 : Baleset vagy rosszullét esetén azonnal orvoshoz kell fordulni (lehetőség szerint mutassa meg a címkét). S36 / 37/39 : Viseljen megfelelő védőruházatot, kesztyűt és szem- / arcvédőt. R mondatok : 8, 26, 34, S-mondatok : 9, 17, 26, 28, 36/37/39, 45, |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Szállítás | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
265 : mérgező és oxidáló gáz (elősegíti a tüzet) ENSZ-szám : 1660 : NITROGÉN-MONOXID, Sűrített; vagy NITRIN-OXID, Sűrített osztály: 2.3 Címkék: 2.3 : Mérgező gázok (megfelel a nagybetűvel T jelölt csoportoknak, azaz T, TF, TC, TO, TFC és TOC). 5.1 : Oxidáló anyagok 8 : Maró anyagok    |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Belélegzés | Veszélyes, halálhoz vezethet | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bőr | Izgató | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Szemek | Irritációt okozhat | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Lenyelés | Terápiás célokra használják, de mellékhatásai vannak, és túladagolás esetén veszélyes | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ökotoxikológia | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Szagküszöb | alacsony: 0,29 ppm magas: 0,97 ppm |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Egység SI és STP hiányában. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
A nitrogén-oxid , oxid nitrogén , nitrogén-oxid vagy NO egy kémiai vegyület képződik egy atom a oxigén- és egy atom nitrogén . Ez egy gáz a normál hőmérséklet és a nyomás . Ez egy fontos neurotranszmitter a emlősökben ; oldva könnyen áthalad a biológiai membránokon, és egyik sejtből a másikba kerül, „ideális parakrin hírvivőt” alkotva .
A nitrogén-monoxidot (NO) nem szabad összetéveszteni más nitrogén-oxidokkal , például az N 2 O dinitrogén-oxiddal , amelyet nevetőgáznak neveznek, és amely általános érzéstelenítő , vagy ismételten, például a nitrogén-dioxid- NO 2 , rendkívül irritáló hatású. és káros vörösbarna gáz, amely a NO gyors oxigén általi oxidációjával keletkezik a levegőben.
A nagy reaktivitást (az oldatfázisban különösen) felé gyökös vegyületek, így például molekuláris oxigén -, amely egy két vegyértékű - vagy a szuperoxid-anion van annak a ténynek köszönhető, hogy ez önmagában egy radikális vegyületet - a centrifugálás teljes elektronika 1/2. Biológiai környezetben felezési ideje 1 és 5 másodperc, vagy akár 30 másodperc között van. A kapott peroxinitritek erős oxidáló és nitráló szerek. Ez megmagyarázza a még mindig rosszul ismert mindenütt jelenlévő hatásokat, az immunválasztástól kezdve a mikrobiális támadásokon és gyulladásos folyamatokon át a szeptikus sokkig és az idegsejtek haláláig az iszkémia fázisában . Részt vesz a memória tanulásának sejtmechanizmusaiban vagy az erekció jelenségében is .
Termelési és környezeti hatások
Ezt a gázt kis mennyiségben szintetizálhatja sok szervezet, beleértve az emberi testet is.
A természetben magas hőmérsékleten nitrogén és oxigén reagálva nitrogén-oxidot kap, például villámlás hatására .
Az emberi tevékenység gyökeresen megváltoztatta a bioszféra nitrogén-oxid termelését , mivel ennek a gáznak nagy mennyisége képződött a belső égésű motorok égéstérében , egyes kazánokban és ipari motorokban, valamint a vegyipar egyes folyamataiban . A katalitikus kipufogógáz-átalakítók egyik célja ennek a reakciónak a megfordítása és a gáz kibocsátásának csökkentése.
Tulajdonságok
A nitrogén-oxid kémiai tulajdonságai nagyon sokak. Az alábbiakban röviden áttekintjük előkészítési módszereit és reakciókészségét.
Készítmény
Az elemekből magas hőmérsékleten nitrogén-oxid képződik, amint azt fentebb megjegyeztük.
A laboratóriumban a következő redoxireakciók szerint szintetizálható, ahol a + II-nél nagyobb oxidációs fokú nitrogénszármazékot (salétromsav: + V; salétromsav: + III) megfelelő redukálószerrel kezeljük. Mindezeket a reakciókat oxigén hiányában kell végrehajtani, mivel ez az NO-t gyorsan nitrogén-dioxiddá oxidálja. :
Így a rézzel hígított salétromsav redukciója
8 HNO 3 + 3 Cu → 3 Cu (NO 3 ) 2 + 4 H 2 O + 2 NOvagy a salétromsavé (in situ képződik) jodid vagy vasionok által
2 NaNO 2 + 2 NaI + 2 H 2 SO 4 → I 2 + 4 NaHSO 4 + 2 NO2 NaNO 2 + 2 FeSO 4 + 3 H 2 SO 4 → Fe 2 (SO 4 ) 3 + 2 NaHSO 4 + 2 H 2 O + 2 NOAz előző reakció egyszerű módszer a NO előállítására a laboratóriumban.
A nitrogén-oxid vízmentes közegben is előállítható a nitrátok és nitritek króm (III) -val történő redukciójának köszönhetően:
3 KNO 2 (l) + KNO 3 (l) + Cr 2 O 3 (s) → 2 K 2 CrO 4 (s) + 4 NOA ipari a NO-szintézis során az oxidációs ammónia által oxigén jelenlétében platinakorom, hogy 750 a 900 ° C-on .
Reakcióképesség
Oxidáció-csökkentés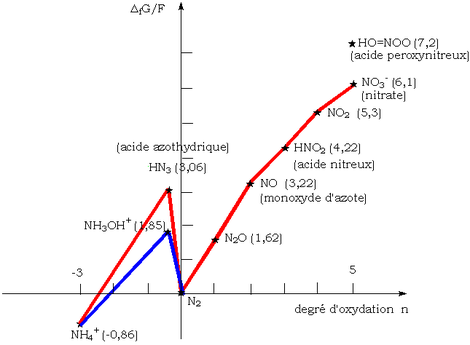
A Frost diagram át pH = 0 a nitrogén világosan mutatja, hogy a nitrogén-monoxid nem stabil, és hogy annak aránytalan be nitrogén N 2.és salétromsav HNO 3. Valójában nagyon könnyen oxidálódik nitrogén-dioxiddá NO 2, stabilabb a levegőben lévő oxigén által. Ezért figyelhető meg ez utóbbi gáz vöröses gőzei, amikor a réz koncentrált salétromsavval oxidálódik.
A kézenfekvő feltételezés az, hogy a kétvegyértékűség O 2 kötődik két, NO gyökök, így BE-OO-NO, amely azután megy homolitikus zavar vezető NO 2 .
Azonban, az oxigén távollétében, ez diszproporcionálódik át körülbelül 50 ° C-on történő dinitrogén-oxid N 2 O(nevetőgáz) és nitrogén-dioxid NO 2(vörös gőzök). A 25 ° C-on , a reakció sebessége gyakorlatilag nulla, és a NO metastabil van.
A vizes oldat, NO feloldódik, amelynek eredményeként salétromossavval HNO 2, a következő lehetséges reakcióséma szerint:
4 NO + O 2 + 2 H 2 O → 4 HNO 2Az NO reagál fluorral , klórral és brómmal , így X-NO típusú vegyületeket kap, amelyek nitrozil-halogenidekként ismertek. A jód túl gyengén oxidálódik ahhoz, hogy nitrozil-jodid képződjön.
A jodrifluor-metán NO-val reagálva a kevés ismert kék gáz egyikét, a nitrozotrifluormetánt kapja:
NO + CF 3 I → I 2 + CF 3 NOA peroxinitrit- ion képződésének sebessége nitrogén-oxidból és szuperoxid-ionból 1,9 × 10 10 mol −1 s −1 , ami in vitro és in vivo peroxinitrit jelenlétét feltételezi két prekurzorának kisebb feleslegében.
DimerizálásA nitrogén-dioxiddal ellentétben a nitrogén-monoxid nem szokott dimerizálni. Ennek a viselkedésnek tulajdonítható az egyetlen elektron eloszlása a teljes molekula felett, valamint az a tény, hogy a legvalószínűbb O = NN = O struktúra változatlanul hagyná a kötések teljes számát (2 × 2,5).
A folyékony fázisban részleges dimerizáció történik. A C 2v (cisz) forma stabilabb, mint transzhomológja, és a C 2h forma (téglalap alakú molekula, amely az egyik molekula nitrogénatomjának a másik oxigénatomjával van összekötve, és fordítva) nem figyelhető meg.
Az ab inito SCF számítások azt mutatták, hogy a dimer (NO) 2 cisz formájának d (NN) = 174 μm és d (OO) = 116 μm távolságok és ONN szög = 107 °. Ezek az értékek jelentősen eltérnek a rendezetlen szilárd fázisú röntgendiffrakciós adatokból levezetett értékektől (lásd a szemközti ábrát). Ez az értékkülönbség megerősíti a dimer tanulmányozásának nehézségét, amelynek kialakulása mulandó.
A nitrogén-oxid szintén ligandum
A nitrogén-monoxid-molekula rokon a szén-monoxid- CO-val, azzal a különbséggel, hogy van egy további elektronja, amely egy anti- kötő pályát foglal el . Így az NO képez hasonló típusú komplexeket, mint a CO-val képződött komplexek, az MN = O kötés szöge gyakorlatilag 180 ° - a valóságban ez a szög 160 ° és 180 ° között változik .
Ezeket a komplexeket ezért lineárisnak tekintjük. Ebben az esetben a nitrogén formálisan bekapcsolja szabad dublettjét a koordinációs kötésben. A nitrogén azonban oxidálódik, mert egyetlen elektronját adja a koordinált fémnek, és ezért redukálódik. Így a tetracarbonylonickel, a nitrosilotricarbonylocobalt és a dicarbonylodinitrosylofer komplexek izostrukturálisak (tetraéderesek), mert az izoelektronikusak .
N O komplexeket képezhet, ha csak egy elektront adományoz a fémnek. Ez egy MNO-csoporthoz vezet, ahol a kötési szög 120 ° és 140 ° között van .
Hídként is funkcionálhat két fémközpont között a nitrogénen keresztül.
Nitrosil-komplexek reakcióiA NO koordináló vegyületek kémiája kiterjedt, és csak röviden tárgyaljuk. Például az NO-t a nióbium és a metil- ligandum közé helyezzük a következő reakcióban:
A koordinált NO jellemzéseA terminális NO-k intenzív infravörös abszorpciójuk alapján ismerhetők fel 1610 cm- 1-nél . A szögletű származékok IR-abszorpciós hullámszáma alacsonyabb.
Mennyiségi elemzés
A nitrogén-oxid legklassikusabb kvantitatív elemzése egyszerű kemilumineszcens reakciót foglal magában az ózonnal.
lásd: A nitrogén-oxidok mérése
Az NO-t tartalmazó mintát felesleges mennyiségű ózonnal keverik össze. A nitrogén-oxid reagál, hogy létrehozzák a oxigén és a di -oxid a nitrogén . A reakció során a látható elektromágneses hullámok formájában is felszabadul az energia: ez a kemilumineszcencia. A fotodetektor segítségével mért fény intenzitása arányos a nitrogén-oxid mennyiségével. Az NO terápiás alkalmazására példa a betegek (főleg asztmások) kilégzett levegőjében történő mérése. Az elv abból áll, hogy kemilunineszcencia készülékben fújunk, és így mérjük a kilélegzett NO-t, és ezért mérjük a légzőrendszer gyulladását.
Az is lehetséges, hogy vizsgáljuk különböző elektrokémiai módszerekkel ( potenciometriával a kálium-permanganát , polarográfiás )
Műszaki alkalmazások
Biológiai funkciók
Az NO egy endogén molekula, amelyet az endothel sejtek , a makrofágok , a májsejtek és az idegsejtek szabadítanak fel .
A testben a nitrogén-monoxid több funkciót is ellát.
A szervezet természetes úton szintetizálja L- argininből és oxigénből számos enzim, az úgynevezett NO- szintáz (NOS), amelyek a citokróm P450-hez közeli hemoproteinek . A katalizátort az oxidációs oxigénnel a iminourea csoport arginin tehát a vas a hem , amely átmegy a oxidáció mértéke + II fok + III és + IV és fordítva.
A kötési, hogy az NO kis molekulatömegű tiolok - például a glutation - kialakulásához vezet az S-nitrozotiolokat ami fontos meghatározója az aktivitás és szállítására NO. Ezek a vegyületek ezt követően NO donorként működhetnek, és ezáltal jelentősen megnövelik felezési idejét.
A nitrogén-oxid sejtaktivitása két lényeges útvonalon halad át, amely abból áll, hogy guanozin-trifoszfátból (GTP) intracelluláris ciklikus guanozin-monofoszfátot (cGMP) állítanak elő , és citotoxikus peroxinitriteket képeznek. A ciklikus GMP koncentrációjának növekedése magában foglalja egy citoplazmatikus (nem membrános) guanilát-cikláz aktiválását .
Értágító
A endothelium a vérerek használ nem trigger relaxációs annak simaizom tunikát , ami értágulatot és megnövekedett véráramot és csökkenti a aggregációját vérlemezkék (trombociták) . Ez a legfontosabb a „nem adrenerg, nem kolinerg” neurotranszmitterek közül ; az erekcióban működik (pénisz, csikló, mellbimbók), és úgy tűnik, hogy fontos szerepet játszik az endothelium megőrzésében is . Az emberek nagy részénél ezt a NO-szintézist elégtelennek találják, ami növeli a szív- és érrendszeri betegségek kialakulásának kockázatát . Ez a mechanizmus megmagyarázza a nitrátok, mint például a trinitrin alkalmazását ugyanezen szívbetegségek kezelésében: Ezek a gyógyszerek NO-vá alakulnak át, még nem teljesen ismert módon, ami viszont tágítja a szívkoszorúereket , a szívet öntöző ereket, vérellátásának növelése.
Az EDRF (endotheliumból származó relaxációs faktor) a NO régi neve. A volt orvosok észrevették értágító szerepét, de még nem azonosították kémiailag.
Mikrobicid
Az immunrendszer makrofágjai , sejtjei NO-t termelnek a bakteriális kórokozók kiküszöbölése érdekében , amelyek olyan körülmények között káros mellékhatásokat okozhatnak, mint az úgynevezett fulmináns fertőzéses szeptikémia , ahol a makrofágok túlzott NO-termelése hatalmas értágulat , a szeptikus sokkban fellépő artériás hipotenzió fő oka .
Neurotranszmitter
Az NO neurotranszmitterként működik az idegsejtek között . Ellentétben a többi neurotranszmitter többségével, amelyeknek a szinaptikus hasadékban kifejtett hatása kizárólag a posztszinaptikus neuronra irányul, a kis NO-molekula széles körben diffundál és számos környező idegsejthez képes eljutni, beleértve azokat az idegsejteket is, amelyek nincsenek összekapcsolva szinapszisokkal. Úgy gondolják, hogy ez a folyamat a memorizálásban vesz részt a hosszú távú memorizálás biztosításával . Az endokannabinoidok , a lipid neurotranszmitterek, hasonló diffúziós tulajdonságokkal rendelkeznek.
Pihentető simaizmok
Az NO az emésztőrendszer számos szervében mint neurotranszmitter, nem adrenerg, nem kolinerg. Feladata a gyomor-bél traktus simaizmainak ellazulása. Különösen növeli a gyomor kapacitását élelmiszer-folyadékok tárolására.
Az apoptózis szabályozója
A nitrogén-oxid a sejtek apoptózisának alapvető szabályozója . Ennek lehet antiapoptotikus hatása, vagy éppen ellenkezőleg, apoptotikus hatása. Ez a kapcsoló szorosan kapcsolódik a sejtes reduktorok, például a glutation jelenlétéhez vagy hiányához .
A jelenlétében a magas szintű szuperoxid O 2 - ion , a nitrogén-monoxid kialakulását teszi lehetővé peroxinitrit ion , valószínűleg felelős a módosítás a mitokondriális membrán potenciál, mint valamint számos jelenség a celluláris apoptózis , különösen., Hogy a sejtek a az immunrendszer.
Exogén NO donorok
Ezek olyan anyagok, amelyek egy vagy több nitrogén - oxigén, nitrogén - nitrogén kötéssel rendelkeznek, vagy gátolják az NO ( viagra ) elpusztítását . Vannak nitrátok , nitritek , nitrátok, azidok ...
Terápiás felhasználások
Terápiás felhasználások:
- Gyógyszeresen inhalációs értágítóként használják . Az inhalációs értágítók használata szelektíven értágítja a kapillárisokat a tüdő jól szellőző területein. Ez lehetővé teszi a hipoxiás vazokonstrikcióval társuló pulmonalis artériás hipertónia csökkentését és a vér oxigénellátásának fokozását.
- Az aszimmetrikus dimetil-arginin (ADMA) nevű vegyület az NO-szintézis ismert gátlója , ezért a kardiovaszkuláris diszfunkció biológiai markernek tekinthető.
- A NO előállítása szintén fontos szerepet játszik a tartós erekció elérésében és fenntartásában. A cGMP megnövekedett koncentrációja jobb értágulathoz és erekcióhoz vezet. Úgy gondolják, hogy a " poppers " hatása az NO közvetítésével is elérhető, ami ellazítja a hímvessző testét ellátó arteriolákat körülvevő simaizomrostokat és növeli a véráramlást. A szildenafil (Viagra) és a tadalafil (Cialis) az 5. típusú foszfodiészteráz (PDE5) enzim kompetitív inhibitorai , amelyek felelősek a GMP ciklikus GMP inaktiválásáért.
A NO biológiai tulajdonságainak felfedezése az 1980-as években teljesen váratlan volt, és némi felfordulást váltott ki. A Science folyóirat 1992- ben a NO "Az év molekulája" nevet kapta , létrehozták a NO Tanult Társaságot, és megjelent egy teljesen NO-nak szentelt tudományos folyóirat. A Nobel-díj in Medicine and Physiology ítélték oda 1998 a Ferid Murad , Robert F. Furchgott és Louis J. Ignarro munkájukért a ingerületátvitel funkciók NO. Ez a munka a francia Nicox gyógyszergyártó cég alapításának eredete . Becslések szerint évente 3000-en jelentek meg tudományos cikkek a nitrogén-monoxid biológiában betöltött szerepéről .
Biztonság
ENSZ-hivatkozás a veszélyes áruk szállítására :
- Név (francia): Sűrített nitrogén-oxid
- Osztály: 2
- száma: 1660
Bibliográfia
- Nathan S Bryan, Janet Zand, Bill Gottlieb, A megoldás: nitrogén-monoxid (NO) , Környezetvédelmi és Egészségügyi Tudományos és Műszaki Intézet (ISTES), 2014, 188 oldal.
Megjegyzések és hivatkozások
- NITROGEN MONOXIDE , a Kémiai Biztonság Nemzetközi Programjának biztonsági adatlapja (i) , konzultálva 2009. május 9-én
- (in) David R. LiDE, Handbook of Chemistry and Physics , CRC,2008. június 16, 89 th ed. , 2736 p. ( ISBN 978-1-4200-6679-1 és 1-4200-6679-X ) , p. 9-50
- számított molekulatömege a „ atomsúlya a Elements 2007 ” on www.chem.qmul.ac.uk .
- (en) Robert H. Perry és Donald W. Green , Perry vegyészmérnökök kézikönyve , USA, McGraw-Hill,1997, 7 -én ed. , 2400 p. ( ISBN 0-07-049841-5 ) , p. 2-50
- " Különböző gázok tulajdonságai ", a flexwareinc.com címen (hozzáférés : 2010. április 12. )
- (a) W. M Haynes, Handbook of Chemistry and Physics , CRC, 2010-2011 91 th ed. , 2610 p. ( ISBN 978-1-4398-2077-3 ) , p. 14–40
- (a) Irvin Glassman, Richard A. Yetter, Combustion , Elsevier,2008, 4 th ed. , 773 p. ( ISBN 978-0-12-088573-2 ) , p. 6.
- (in) David R. LiDE, CRC Handbook of Chemistry and Physics , CRC Press,2009, 90 th ed. , 2804 p. , Keménytáblás ( ISBN 978-1-4200-9084-0 )
- (in) David R. LiDE, Handbook of Chemistry and Physics , CRC,2008, 89 th ed. , 2736 p. ( ISBN 978-1-4200-6679-1 ) , p. 10-205
- " Nitrogén-monoxid " a vegyi termékek adatbázisában Reptox of the CSST (quebeci szervezet, amely a munkavédelemért felelős), hozzáférés: 2009. április 25.
- " Nitric oxide " , a hazmap.nlm.nih.gov címen (hozzáférés : 2009. november 14. )
- Crépel, F., & Lemaire, G. (1995) nitrogén-oxid . ; MS folyóirat (orvostudomány / tudomány); 11: 1639–42 (PDF, 4 oldal)
- Gabbai, FB, Garcia, GE és mtsai. , A nitrogén-oxid szerepe a glomeruláris fiziológiában és a patofiziológiában , Adv Nephrol Necker Hosp 24, 3-18 (1995)
- RA Schroeder és PC-Kuo, nitrogén-monoxid: fiziológiai és farmakológiai , Analg 81, 1052-9 (1995)
- A peroxinitrit-ion nitráttá történő izomerizációjának entalpiája
- Sennequier, N. és Vadon-Le Goff, S. (1998). A nitrogén-monoxid (NO) bioszintézise: mechanizmus, szabályozás és szabályozás. KISASSZONY. Orvostudományok, 14 (11), 1185-1195 ( http://cat.inist.fr/?aModele=afficheN&cpsidt=1584829 összefoglaló])
- De Soete, G. (1993). Dinitrogén-oxid az égésből és az iparból: kémia, emissziók és ellenőrzés Dinitrogén-oxid az égésből és az iparból: kémia, kibocsátások és redukciós technikák ( összefoglalás ).
- RB király; A fő csoportelemek szervetlen kémiája, VCH Publishers, New York, 1995.
- Química Nova - A peroxinitrit, egy biológiai toxin kémia
- Greenwood NN és Earnshaw A. (1997). Az elemek kémiája. 2 th Ed. Elsevier, p. 446 .
- Skanckea PN és Boggsb JE (1973). Az (NO) 2 szerkezetének elméleti vizsgálata. Kémiai Fizikai Betűk (21) p. 316-317 .
- Lipscomb WN, Wang FE, May WR és Lippert EL (1961). Megjegyzések az 1,2-diklór-etán és az N202 szerkezetére vonatkozóan. Acta.Cryst. (14) o. 1100-01 .
- FA Cotton, G. Wilkinson, CA Murillo, M. Bochmann; Haladó szervetlen kémia, 6. kiadás Wiley-Interscience, New York, 1999.
- Fischer G & Becknell D; Anális. Chem., 44 , 863, 1972
- Kieselbach, ind. Eng. Chem., Anal. Ed., 16 , 766, 1944
- Pharmacorama; Nitrogén-monoxid
- nitrogén-oxid szintáz egy citokróm P-450 típusú h ... [Biokémia. 1992] - PubMed eredmény
- Andrews, KL, Triggle, CR és mtsai. NEM és az érrendszer: honnan származik és mit csinál? Szívelégtelenség Rev. 7, 423-45 (2002)
- Nitrogén-oxid anyagcsere
- Giuliano, F., Rampin, O., Benoit, G., & Jardin, A. (1997). Az erekció perifériás farmakológiája . Urológiai fejlődés, 7. cikk (1), 24-33.
- nitrogén-oxid az apoptózis bifunkcionális szabályozójaként
- A peroxinitritek kémiája
- A NO és a peroxinitritek kontrasztos hatása a humán monociták HSP70 expressziójára és apoptózisára; Adrie C és társai. Am J Physiol Cell Physiol 279: 452-460, 2000.
- HIV-1 által kódolt glutation-peroxidáz funkcionális vizsgálata
- NO és NO-donorok
- Nátrium-azid mint közvetett nitrogén-oxid donor: kutatások a patkány aorta izolált szegmensein; Ukr Biokhim Zh. 2005. július-augusztus; 77 (4): 120-3
- a nitrogén-monoxid klinikai alkalmazása; Olson G.
- 1998-ban az orvosi Nobel-díj az NO szerepének felfedezéséért a szív- és érrendszeri szabályozásban
- A megoldás: nitrogén-monoxid (NO) , Louis-Marie Houdebine felolvasási jegyzete, pseudo-sciences.org, 2014. december 31.
Lásd is
- Akut légzési distressz szindróma
- Neurotranszmitter
- EDRF: Endothelium eredetű relaxációs faktor név, amelyet ugyanannak a molekulának adnak, mielőtt megismernénk annak kémiai képletét
- Jelátvitel
- A nitrogén-oxidok mérése
Külső hivatkozás
- Nitrogén-oxid: Biológia és kémia , tudományos folyóirat








