Molekuláris szimmetria
A molekuláris szimmetria , a kémia , hogy leírja a szimmetria jelen lévő molekula (vagy egy kristály ), és hogy osztályozzák a molekulák aszerint, hogy azok a szimmetria.
A molekuláris szimmetria a kémia egyik alapvető fogalma, mert számos kémiai tulajdonság megértését vagy előrejelzését teszi lehetővé . Olyan matematikai eszközöket mozgósít , mint a csoport fogalma , különösen a szimmetriacsoport és a pontszimmetriacsoport .
A molekuláris kémia, a koordinációs komplexek vizsgálata, a molekuláris pályák vizsgálata , valamint a molekuláris entitások és komplexek spektroszkópiája a Schoenflies-jelölés segítségével írja le, hogy a molekula melyik szimmetriacsoporthoz kapcsolódik. A kristálytanban helyette a Hermann-Mauguin szimbólumokat használják .
A szimmetria műveletei többféleképpen ábrázolhatók . Ezt megtehetjük például olyan mátrixokkal, amelyek oszlopai egy adott bázis esetében az új vektorok koordinátáit ábrázolják, amelyeket az alap vektorainak szimmetria működtetésével történő átalakítása után kapunk. Ennek a mátrixnak a nyomát az ábrázolás karakterének nevezzük.
A csoport nem redukálható reprezentációit gyakran használják, mivel a csoport minden más reprezentációja leírhatatlan irreducibilis reprezentációk közvetlen összegeként ( Maschke tétele ).
A szimmetriaművelet olyan geometriai transzformáció, amely ekvivalens atomokat cserél, vagy az atomokat változatlanul hagyja. Az egyes pontcsoportokhoz egy karaktertábla foglalja össze a csoport szimmetriaműveleteivel és annak visszavonhatatlan reprezentációival kapcsolatos információkat. Így létrehozhatunk egy listát a kémia szempontjából hasznos karaktertáblákról (en) . Ezekben a táblázatokban minden sor egy redukálhatatlan ábrázolásnak felel meg (szimmetriai címkével jelölve), minden oszlop egy szimmetriai műveletnek (amelyet Schoenflies jelölésével jelölünk), az utolsó két oszlop pedig azt jelzi, hogy melyek a szokásos vektorok, különösen az atompályák , amelyek követik az egyes redukálhatatlan ábrázolások által jelzett átalakulásokat.
Valójában, ha annak a csoportnak az összes szimmetriaművelete, amelyhez a molekula kapcsolódik, ez utóbbit változatlanul hagyja, a csoport művelete nem feltétlenül hagyja az egyes vektorokat változatlannak. A figyelembe vett vektorok gyakran atompályák vagy űrvektorok, amelyek variációja molekuláris rezgést ír le . Ezért csatolunk ezekhez a pályákhoz vagy ezekhez a vektorokhoz egy szimmetriai címkét, amely megfelel annak "redukálhatatlan reprezentációjának a molekula csoportjában, vagyis a csoport redukálhatatlan reprezentációjának, amely leírja a transzformációkat. vektornak tekinthető. Tehát azt mondani, hogy két molekulapálya "azonos szimmetriájú", azt jelenti, hogy ugyanaz a redukálhatatlan ábrázolás. Ezt a szókincset különösen a spektroszkópiában használják, ahol a két energiaszint közötti átmenet "szimmetria megengedettnek" tekinthető, ha ugyanazon szimmetriájú két pálya között fordulnak elő, az itt megadott értelemben.
Szimmetria műveletek és szimmetria elemek
Öt olyan szimmetriaműveleti család létezik, amelyek változatlanul hagyhatják a molekula geometriáját: visszaverődések, inverziók, forgások, helytelen forgatások és a semleges elem. Minden szimmetriaművelet egy olyan szimmetriaelemhez kapcsolódik, mint egy tengely, sík vagy középpont: például a szimmetriatengely körül egy elfordulást végeznek, és a szimmetriasíkhoz viszonyítva visszaverődnek.
Forgások
Ha egy molekula egy adott tengely körüli elfordulásával a molekula azonos a kezdeti molekulával, akkor a kérdéses tengelyről azt mondjuk, hogy n nagyságrendű forgástengely, amelyet a C n szimbólum jelöl . Például bór-trifluoriddal (BF 3 ) a molekulasíkra merőleges tengely egy C 3 tengely . Ez a tengely három forgatási műveletet generál: C 3 , C 3 2 és C 3 3 = E (a semleges elem, lásd alább).
Ha egy molekulának több forgástengelye van, akkor a legnagyobb rendû tengelyt fõtengelynek nevezzük . Bór-trifluoriddal a C 3 tengely a fő forgástengely. Három egyenértékű C 2 tengely is van , egy-egy minden B-F kapcsolaton, mert egy F-n áthaladó link körül 180⁰-os elforgatás csak a másik két F-et cseréli fel.
Egy lineáris molekula, mint HCI vagy HC≡CH, a molekuláris-tengely egy tengelye végtelen érdekében C ∞ , mert van egy végtelen számú elfordulási szögek, amelyek molekulák azonosak a kezdeti molekulához.
Gondolatok
A molekula egy síkban való visszaverődését szimmetriaműveletnek nevezzük, amikor ez a kezdeti molekula hasonló másolatát generálja. Ebben az esetben a sík reflexió a szimmetriaelem nevezett szimmetriasíkjához vagy tükörsík , és jelöli ki a szimbólumot σ (szigma = s görög, a német szó Spiegel = tükör).
A formaldehid (H 2 CO) molekulának két úgynevezett függőleges tükörsíkja van (v szimbólum), mert ezek tartalmazzák a molekula forgástengelyét (C 2 ). A σ v jelölésű sík áthalad a két hidrogén között, és ebben a síkban a visszaverődés kicseréli a két hidrogént egymással. A σ v ' jelölésű sík tartalmazza a két hidrogént, amelyeket ezután ebben a síkban reflexióval nem helyettesítenek. Ha egy molekula egynél több forgástengelyt tartalmaz, úgynevezett függőleges sík tartalmazza a fő tengelyt.
Más molekulákban van egy vízszintes sík (σ h ), amely merőleges a fő tengelyre. A BF 3-ban például a molekula síkja σ h, mert merőleges a C 3 tengelyre .
Az inverzió
Egy molekulának van inverzióközéppontja (rövidítve i ) vagy szimmetriaközpontja, ha a molekula minden atomján a középponton kívül található egy másik azonos atom közvetlenül a központon keresztül és a központtól egyenlő távolságban. Valóban, ha a szimmetria középpontja a koordináták kezdőpontjában van, akkor az azonos atomok az (x, y, z) és (−x, −y, −z) pontokban találhatók. Az inverziós művelet magában foglalja az egyes atomok áthelyezését a központ másik oldalán lévő azonos atomokba.
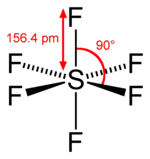
Lehet, hogy nincs atom a közepén. Például a kén-hexafluorid (SF 6 ) van oktaéderes és annak központja inverzió a kénatom, míg a benzol (C 6 H 6 ) hatszög síkban és a középpontja az inverzió a központ a gyűrű, ahol nincs atom talált .
Helytelen forgatások
Egyes molekulákban a C n forgás (az úgynevezett szorzat) és az erre a tengelyre merőleges síkban történő visszaverődés kombinációja szimmetriaművelet lehet, még akkor is, ha a forgás önmagában vagy a visszaverődés nem szimmetriaművelet. Ebben az esetben a szimmetria működését forgatás-visszaverődésnek vagy helytelen forgatásnak nevezzük (S n szimbólum ).
Például az etánban lévő CC kötés nem a C 6 szimmetriatengely (bár a C 3 tengely ), és ennek a kötésnek a középpontjában lévő σ h merőleges sík sem szimmetriasík. Az S 6 = σ h C 6 (vagy másképp C 6 σ h ) szorzat azonban valóban szimmetriaművelet, mert minden atomot ekvivalens atomba visz. Az S 6 tengely az S 6 , S 6 2 = C 3 , S 6 3 = S 2 = i, S 6 4 = C 3 2 , S 6 5 és S 6 6 = E műveleteket generálja .
Az S 1 tengely a visszaverődés síkjának felel meg (forgás nélkül), az S 2 tengely pedig az inverzió középpontjának felel meg. Tetraéderes molekulát, például a metán három S 4 tengely .
A semleges elem
A csoport semleges eleme (vagy identitási eleme) rövidítve E, a német „Einheit” szóból, amely egységet jelent. Minden molekulának van ilyen eleme, amely nem változtat a molekulán. Bár ez az elem triviálisnak tűnik, matematikai csoportnak kell lennie a szimmetria elemek halmazában , amelynek meghatározása megköveteli az identitás elem felvételét. Valóban hasonlít az eggyel való szorzás matematikai műveletéhez, amely nem változtatja meg azt a számot, amelyre hat.
Szimmetriacsoportok
Matematikai csoportok
A molekula (vagy más tárgy) szimmetriai műveletei csoportot alkotnak . A matematikában a csoport olyan bináris művelettel rendelkező halmaz, amely kielégíti az alábbi négy csoporttulajdonságot.
Egy szimmetriacsoportban a csoport elemei a szimmetriaműveletek (nem a szimmetriaelemek), és két elem bináris kombinációja (vagy szorzata) először szimmetriaműveletet, majd l 'másikat jelent. Például a szekvenciája egy rotációs C 4 körül a z-tengely követte, és reflexió az xy síkban kijelölt σ (xy) C 4 . Megállapodás szerint a műveletek sorrendje jobbról balra.
A szimmetriacsoport betartja azokat a tulajdonságokat, amelyek bármely csoportot meghatározzák:
(1) Zárási tulajdonság : A G csoport minden egyes x és y elempárjára az xy szorzat is ugyanabba a csoportba tartozik. Ez azt jelenti, hogy a csoport zárt, így két elem kombinálása nem hoz létre új elemet. A szimmetria műveleteinek mindez a tulajdonsága, mert két művelet sorrendjének egy harmadik állapotot kell előállítania, amely megkülönböztethetetlen a második állapottól, majd az első állapottól is, így a molekulára gyakorolt nettó hatás mindig szimmetriaművelet.
(2) Asszociatív : A G csoport minden egyes x , y és z esetében a két hármas kombináció ( x y ) z és x ( y z ) ugyanazt az elemet adja G-ben . Vagyis ( x y ) z = x ( y z ) minden x , y és z ∈ G esetén .
(3) Semleges elem megléte . Bármely G csoportnak tartalmaznia kell egy semleges elemet (vagy azonosító elemet) E, hogy az E szorzata bármely G elemgel együtt változatlanul hagyja az elemet: xE = Ex = x. A molekuláris szimmetria egy csoportja számára a semleges elem az, hogy bármely atomot változatlanul hagyjon.
(4) Minden elem inverzének megléte . Minden egyes elem X a G , van egy inverz elem y olyan, hogy xy = yx = E . Például egy adott irányú forgás fordítottja ugyanazon a szögben történő, de a másik irányú elfordulás.
A csoport sorrendje a csoportban lévő elemek száma.
A szimmetria pontcsoportjai
Az egymást követő alkalmazás (amelyet egy molekula két vagy több szimmetriai műveletének összetételének nevezünk) egyetlen szimmetriaműveletnek felel meg. Például egy C 2 forgatás, majd egy σ v visszaverődés egyenértékű a σ v ' visszaverővel . Ezt írják σ v * C 2 = σ v ', ahol az egyezmény szerint az első műveletet jobbra írják. A molekula összes szimmetriaműveletének halmaza (beleértve a kompozíciókat is) engedelmeskedik a csoport összes tulajdonságának.
Azt mondják, hogy ez a csoport a molekula pontszimmetria csoportja . A pontos szó azt jelenti, hogy a szimmetriaműveletek halmaza legalább egy rögzített pontot hagy a térben. (Bizonyos műveleteknél egy teljes tengely vagy egy teljes sík rögzített marad.) A pontcsoport magában foglalja az összes olyan műveletet, amely fixen hagyja az adott pontot. Másrészt, a szimmetria egy kristály írja le egy tércsoport , amely magában foglalja a transzlációs műveletek térben.
Példák pontszimmetria csoportokra
Pontcsoportot rendelve az egyes molekulákhoz, a molekulákat hasonló szimmetriai tulajdonságokkal rendelkező kategóriákba sorolja. Például a PCl 3 , a POF 3 , a XeO 3 és az NH 3 ugyanazon hat szimmetriai művelet együttese. Mindannyian áteshetnek az E semleges elemen, két különböző C 3 forgatáson és három különböző σ v visszaverődésen anélkül, hogy megváltoztatnák a geometriájukat, tehát mindegyiküknek ugyanaz a 6 sorrendű pontcsoportja, az úgynevezett C 3v .
Ugyanígy a víz (H 2 O) és a hidrogén-szulfid- (H 2 S) azonos szimmetriai műveletekkel is rendelkezik. Mindketten átmennek az E semleges elemen, egy C 2 forgáson és két σ v és σ v ' visszaverőn . Ez a készlet megfelel a 4. sorrend C 2v pontcsoportjának .
A mellette folyamatábra lehetővé teszi számunkra, hogy azonosítsuk a molekulák túlnyomó többségének szimmetriai pontcsoportját. Ez a rangsorolási rendszer segíti a tudósokat a molekulák hatékonyabb tanulmányozásában, mivel a hasonló kémiai természetű és azonos szimmetriai csoportú molekulák általában hasonló kötéskészletekkel és hasonló spektroszkópiai tulajdonságokkal rendelkeznek.
A pontcsoportok táblázata
Ez a táblázat a kémia és a molekulaspektroszkópia során alkalmazott Schoenflies-jelölés szerint elnevezett közös pontcsoportok listáját tartalmazza . A bemutatott struktúrák magukban foglalják a molekulák közös alakjait, amelyek gyakran a VSEPR elméletével magyarázhatók .
| Pontcsoport | Szimmetria műveletek | A tipikus geometria egyszerű leírása | 1. példa | 2. példa | 3. példa |
| C 1 | E | nincs szimmetria, királis |
 bróm-klór-fluor-metán (két enantiomert jelölve) |
 Lizergsav |
 L-leucin és a legtöbb más a-aminosav, a glicin kivételével |
| C s | E σ h | tükörsík, nincs más szimmetria |
 tionil-klorid , SOCl 2 |
 hipoklorinsav |
 klór-jód-metán |
| C i | E i | inverzió központ |
 Mezotartársav |
( S , R ) 1,2-dibróm-1,2-diklór-etán ( anti konformer ) | |
| C ∞v | E 2C ∞ Φ ∞σ v | lineáris |
 hidrogén-fluorid (és bármely más heteronukleáris diatomiás molekula) |
 dinitrogén-oxid |
 hidrogén cianid |
| D ∞h | E 2C ∞ Φ ∞σ i i 2S ∞ Φ ∞C 2 | lineáris az inverzió középpontjával |
 dioxigén (és bármely más Homonukleáris kétatomos molekula) |
 szén-dioxid |
 acetilén (etin) |
| C 2 | EC 2 | "nyitott könyv geometria", királis |
 hidrogén-peroxid |
 hidrazin |
 tetrahidrofurán (sodrott konformáció) |
| C 3 | EC 3 | légcsavar , királis |
 trifenil-foszfin |
 trietil-amin |
 Foszforsav |
| C 2h | EC 2 i σ h | inverziós középponttal rendelkező sík, nincs függőleges sík |
 transz - 1,2-diklór-etén |
 transz - dinitrogén - difluorid |
 transz - azobenzol |
| C 3h | EC 3 C 3 2 σ h S 3 S 3 5 | légcsavar |
 bórsav |
 floroglucinol (1,3,5-trihidroxi-benzol) |
|
| C 2v | EC 2 σ v (xz) σ v '(yz) | ferde (szögletes) (H 2 O) vagy libikóka (SF 4 ) vagy T-alakú (ClF 3 ) |
 víz |
 kén-tetrafluorid |
 klór-trifluorid |
| C 3v | E 2C 3 3σ v | trigonális piramis |
 ammónia |
 Foszforil-triklorid , POCl 3 |
 Kobalt-hidrokarbonil , HCo (CO) 4 |
| C 4v | E 2C 4 C 2 2σ v 2σ d | négyzetes alapú piramis |
 xenon-oxitetrafluorid |
 pentaborane (9) , B 5 H 9 |
 nitroprusszid anion [Fe (CN) 5 (NO)] 2− |
| C 5v | E 2C 5 2C 5 2 5σ v | szék |
 Ni (C 5 H 5 ) (NO) |
 korannulén |
|
| D 2 | EC 2 (x) C 2 (y) C 2 (z) | csavart királis |
 bifenil ( bal konform ) |
 csavaros (C 10 H 16 ) |
Ciklohexán: csavart hajó-konform |
| D 3 | EC 3 (z) 3C 2 | hármas spirál, királis |
 kation-trisz (etilén-diamin) kobalt (III) |
 vas (III) tris (oxalato) anion |
|
| D 2h | EC 2 (z) C 2 (y) C 2 (x) i σ (xy) σ (xz) σ (yz) | sík inverziós középponttal és függőleges síkokkal |
 etilén |
 pirazin |
 diborán |
| D 3h | E 2C 3 3C 2 σ h 2S 3 3σ v | trigonális sík |
 bór-trifluorid |
 foszfor-pentaklorid |
 ciklopropán |
| D 4h | E 2C 4 C 2 2C 2 '2C 2 " i 2S 4 σ h 2σ v 2σ d | négyzet alakú sík |
 xenon-tetrafluorid |
 oktaklór-dimolibdát (II) anion |
 Transz - [Co III (NH 3 ) 4 Cl 2 ] + (H atomok nélkül) |
| D 5h | E 2C 5 2C 5 2 5C 2 σ h 2S 5 2S 5 3 5σ v | ötszögű |
 ciklopentadienil-anion |
 Rutenocén |
 C 70 |
| D 6h | E 2C 6 2C 3 C 2 3C 2 '3C 2 ' ' i 2S 3 2S 6 σ h 3σ d 3σ v | hatszögletű |
 benzol |
 bisz (benzol) króm |
 koronén (C 24 H 12 ) |
| D 7h | EC 7 S 7 7C 2 σ h 7σ v | hétszögletű |
 Tropilium ion (C 7 H 7 + ) |
||
| D 8h | EC 8 C 4 C 2 S 8 i 8C 2 σ h 4σ v 4σ d | nyolcszögű |
 Cyclooctatetraenide anion (C 8 H 8 2- ) anion |
 uranocén |
|
| D 2d | E 2S 4 C 2 2C 2 '2σ d | 90 ° -ban megcsavarodva |
 allén |
 tetrakén-tetranitrid |
 diborán (4) (gerjesztett állapot) |
| D 3d | E 2C 3 3C 2 i 2S 6 3σ d | 60 ° -ban megcsavarodva |
 etán ( lépcsőzetes konformáció ) |
 dikobalt-oktakarbonil ( híd nélküli izomer) |
 ciklohexán a szék alakjában |
| D 4d | E 2S 8 2C 4 2S 8 3 C 2 4C 2 '4σ d | 45 ° -ban megcsavarodva |
 ciklooktaszulfur (S 8 ) |
 Dimangán-dekakarbonil (eltolt rotamer ) |
 oktafluoroxenátion (ideális geometria) |
| D 5d | E 2C 5 2C 5 2 5C 2 i 2S 10 3 2S 10 5σ d | 36 ° -ban megcsavarodva |
 ferrocén (eltolódott rotamer) |
||
| S 4 | E 2S 4 C 2 |
 1,2,3,4-tetrafluor-spiropentán |
|||
| T d | E 8C 3 3C 2 6S 4 6σ d | tetraéder |
 metán |
 foszfor-pentoxid |
 adamantán |
| O h | E 8C 3 6C 2 6C 4 3C 2 i 6S 4 8S 6 3σ h 6σ d | oktaéderes vagy köbös |
 kén hexafluorid |
 Molibdén-hexakarbonil |
 kubai |
| Én h | E 12C 5 12C 5 2 20C 3 15C 2 i 12S 10 12S 10 3 20S 6 15σ | ikozaéderes vagy dodekaéderes |
 Buckminsterfullerene (C 60 ) |
 dodecaborát anion |
 Dodekaéder |
Megjegyzések és hivatkozások
- Alain Sevin et al., Általános kémia - az egész pálya fájlokat , Dunod,2012, P. 16-17
- Brian Pfennig , A szervetlen kémia alapelvei , Wiley, 191 p. ( ISBN 978-1-118-85910-0 )
- Brian Pfennig , Principles of Inorganic Chemistry , Wiley ( ISBN 978-1-118-85910-0 )
- Gary Miessler , Inorganic Chemistry , Pearson,2004( ISBN 9780321811059 , online olvasás )
- Gary L. Miessler , Inorganic Chemistry , Prentice-Hall,1999, 2. kiadás , 621-630 p. ( ISBN 0-13-841891-8 )
- Modell: Housecroft3rd
